SCI IMMUNOL | 肖晖研究组揭示LRRC8/VRAC转运cGAMP提升NK和T细胞的杀伤功能促进肿瘤放/化疗的新机制
6月27日,肖晖研究组与复旦大学附属眼耳鼻喉科医院李华斌课题组合作,在国际著名期刊Science Immunology上发表了题为“Radiotherapy Enhances Anticancer CD8 T Cell Responses by cGAMP Transfer through LRRC8A/C Volume-Regulated Anion Channels” 的研究论文, 揭示了LRRC8/VRAC通过转运肿瘤放/化疗过程中产生的cGAMP进入T细胞,增强T细胞和NK杀伤肿瘤的功能,促进肿瘤治疗的新机制。

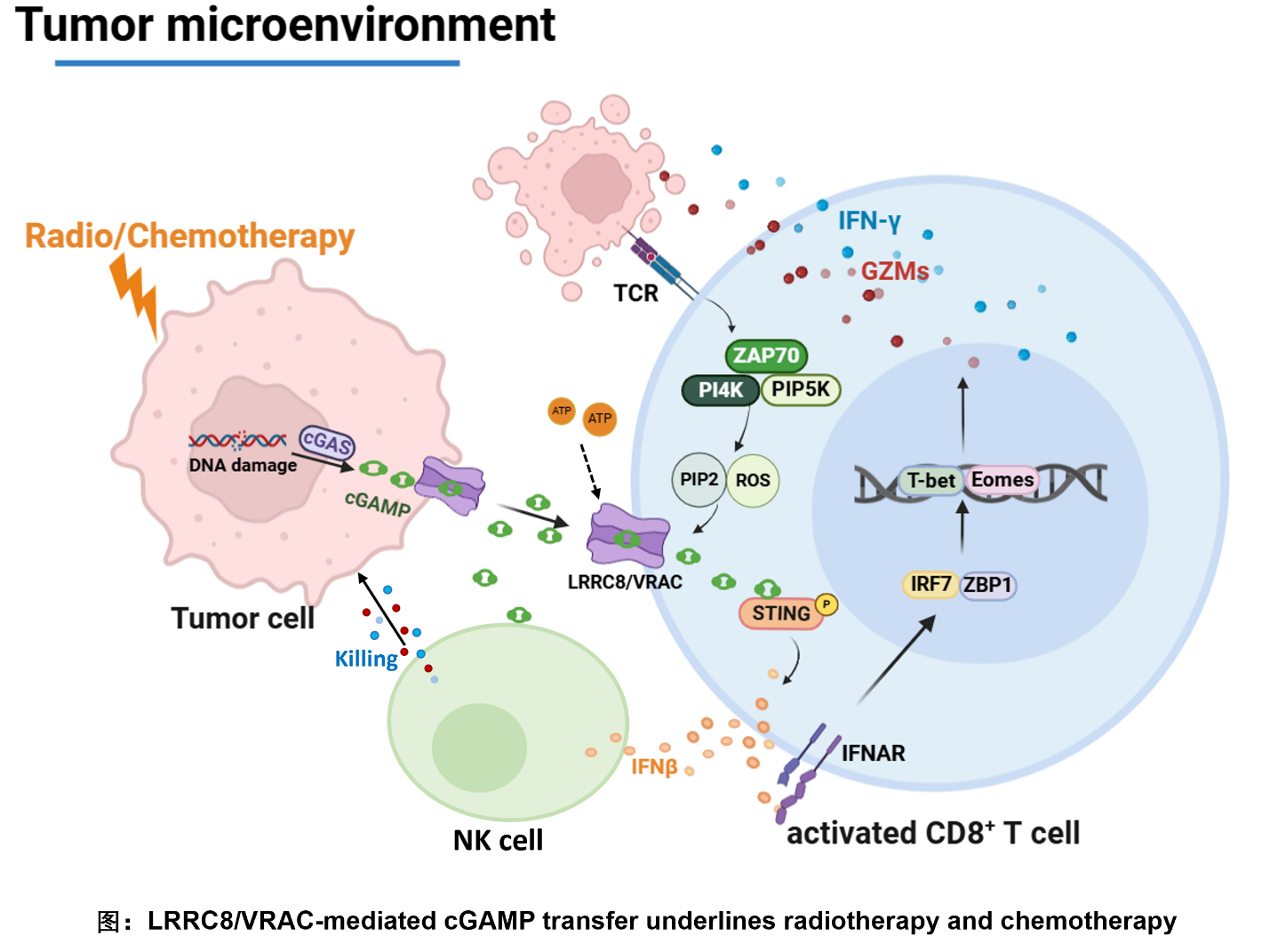
放疗和化疗虽然广泛应用于临床肿瘤治疗,但它们的疗效深受个体的遗传特征和免疫微环境的影响。cGAS-cGAMP-STING信号通过诱导I型干扰素表达在促进肿瘤免疫中发挥至关重要的作用,但如何靶向这一信号通路提升放/化疗的临床治疗效果仍然是肿瘤免疫研究的热点和前沿。
基于研究组前期发现的cGAMP转运通道LRRC8/VRAC在感应低渗、炎症因子和ATP等信号后促进cGAMP从病毒感染细胞转移到非感染细胞中激活STING、诱导旁观者细胞表达I型干扰素清除病毒这一现象(Immunity 2020; J Immunol 2021 & 2024),研究者进一步揭示LRRC8/VRAC是将cGAMP从肿瘤细胞转移到免疫细胞中的关键通道。质谱定量分析表明放疗和化疗导致肿瘤产生和输出大量的cGAMP,它们通过LRRC8/VRAC进入肿瘤浸润的CD4和CD8 T 细胞中,激活STING和I型干扰素表达、增强NK和CD8 T细胞的肿瘤杀伤功能。这一研究首次发现肿瘤抗原与TCR结合是开放LRRC8/VRAC通道的关键信号,并证明ZAP70和PI4K/PIP5K下游的产物PI(4,5)P2和ROS是激活VRAC转运cGAMP的关键分子。该研究还发现联合抑制胞外水解酶ENPP1和CD39可促进cGAMP从肿瘤到免疫细胞的转移,增强放疗的治疗效应。结合对肿瘤病人样本的分析,该研究不仅揭示了放疗与化疗通过LRRC8/VRAC转移cGAMP塑造免疫微环境的新机制,还为临床治愈肿瘤提供了新的靶向策略。
肖晖研究员为该论文的通讯作者,复旦大学附属眼耳鼻喉科医院李华斌教授为共同通讯作者;博士后曹李敏为论文第一作者。该研究得到了上海交通大学免疫研究所的叶幼琼教授和药学院的邓刘福教授、上海科技大学的王皞鹏教授、约翰霍普金斯大学的Zhaozhu Qiu教授、上海同济大学的贾鑫明教授、山东大学的高成江教授、中国科学院分子细胞科学卓越创新中心的陈剑峰教授、上海营养与健康研究所的肖意传和章海兵教授、张晓明和孟广勋教授等团队的大力支持;并得到了国家自然科学基金委重点项目、中国科学院战略性先导科技专项B类、国家科技部重点研发计划、免疫应答与免疫治疗全国重点实验室、苏州市科技计划及苏州市重点医学学科项目的支持。
原文链接:https://www.science.org/doi/10.1126/sciimmunol.adn1630
附件下载: