6月25日,来自中国科学院上海巴斯德研究所的刘星研究员团队与美国哈佛大学医学院Judy Lieberman教授团队以研究长文(Research Article)形式在《Science》杂志发表题为The lysosomal Rag-Ragulator complex licenses RIPK1- and Caspase-8-mediated pyroptosis by Yersinia的论文,报道通过CRISPR/Cas9全基因组敲除筛选鉴定出耶尔森菌感染并触发细胞焦亡的关键因子—Rag-Ragulator复合物,并揭示该复合物激活FADD-RIPK1-Caspase-8(complex Ⅱ)的分子机理。

耶尔森菌(Yersinia)是广泛存在于自然界的一种革兰氏阴性菌,属内多个菌种具有极高人类致病毒性,其中鼠疫耶尔森菌是烈性传染病鼠疫的病原菌;肠炎耶尔森菌可致胃肠炎、关节炎及败血症等。细胞焦亡(pyroptosis)是一种依赖gasdermin家族蛋白质膜打孔而引发的新型细胞程序性死亡,是机体免疫系统对抗病原菌入侵的主要手段之一,亦是近些年固有免疫和肿瘤免疫治疗领域研究热点。细胞发生焦亡时,可通过释放促炎因子招募免疫细胞并清除入侵病原体1-5。自本世纪初“焦亡”概念提出以来,大量研究结果显示革兰氏阴性菌感染后宿主细胞主要通过炎性caspase介导的炎症小体(Inflammasome)活化和gasdermin D(GSDMD)切割触发细胞焦亡6-10。2018年,马萨诸塞医学院Egil Lien和塔夫茨医学院Alexander Poltorak课题组相继发现耶尔森菌分泌的毒力蛋白YopJ通过抑制TAK1激活RIPK1/caspase-8,从而进一步切割GSDMD导致焦亡11,12,但抑制后的TAK1如何激活RIPK1/caspase-8的分子机制尚不清晰。
在本研究中,研究人员首先利用LPS + 5z7(TAK1抑制剂)处理模拟耶尔森菌感染,通过CRISPR/Cas9全基因组敲除筛选发现Rag-Ragulator复合物(包含RagA、RagC和Lamtor1-5)参与调控了耶尔森菌感染诱发的细胞焦亡。验证实验结果显示Rag-Ragulator复合物特异性地参与TLR/TNF-caspase-8-GSDMD通路介导的细胞焦亡,而不参与经典或非经典炎症小体介导的细胞焦亡。进一步研究发现Rag-Ragulator的功能缺失能够显著抑制complex Ⅱ的形成、RIPK1磷酸化和caspase-8激活,提示Rag-Ragulator作用于complex Ⅱ上游。功能结构域Mapping实验结果显示RagC分别与RIPK1蛋白N端kinase domain和caspase-8蛋白C端caspase domain相互作用。进一步共定位免疫荧光染色结果显示,在刺激条件下RIPK1和caspase-8能够被招募到溶酶体,而这一过程依赖于Rag-Ragulator复合物。之后研究人员详细探究了Rag-Ragulator复合物发挥作用机制:1)过表达溶酶体膜定位缺失突变体Lamtor1 3A能够显著抑制耶尔森菌感染诱导的细胞焦亡;2)GDP而非GTP形式的RagC能与RIPK1/caspase-8结合并促进细胞焦亡;3)缺失FLCN-FNIP2的细胞能够抵抗细胞焦亡的发生,而在该细胞中表达GDP形式的RagC可回复焦亡状态。
综上,该研究阐释了溶酶体定位的Rag-Ragulator复合物在耶尔森菌感染中的新功能,并详细解析了耶尔森菌感染后宿主细胞内RIPK1/caspase-8活化分子机制,是对细胞焦亡领域一大拓展,也为如鼠疫耶尔森菌和肠炎耶尔森菌感染相关疾病治疗提供了新靶点和新思路。
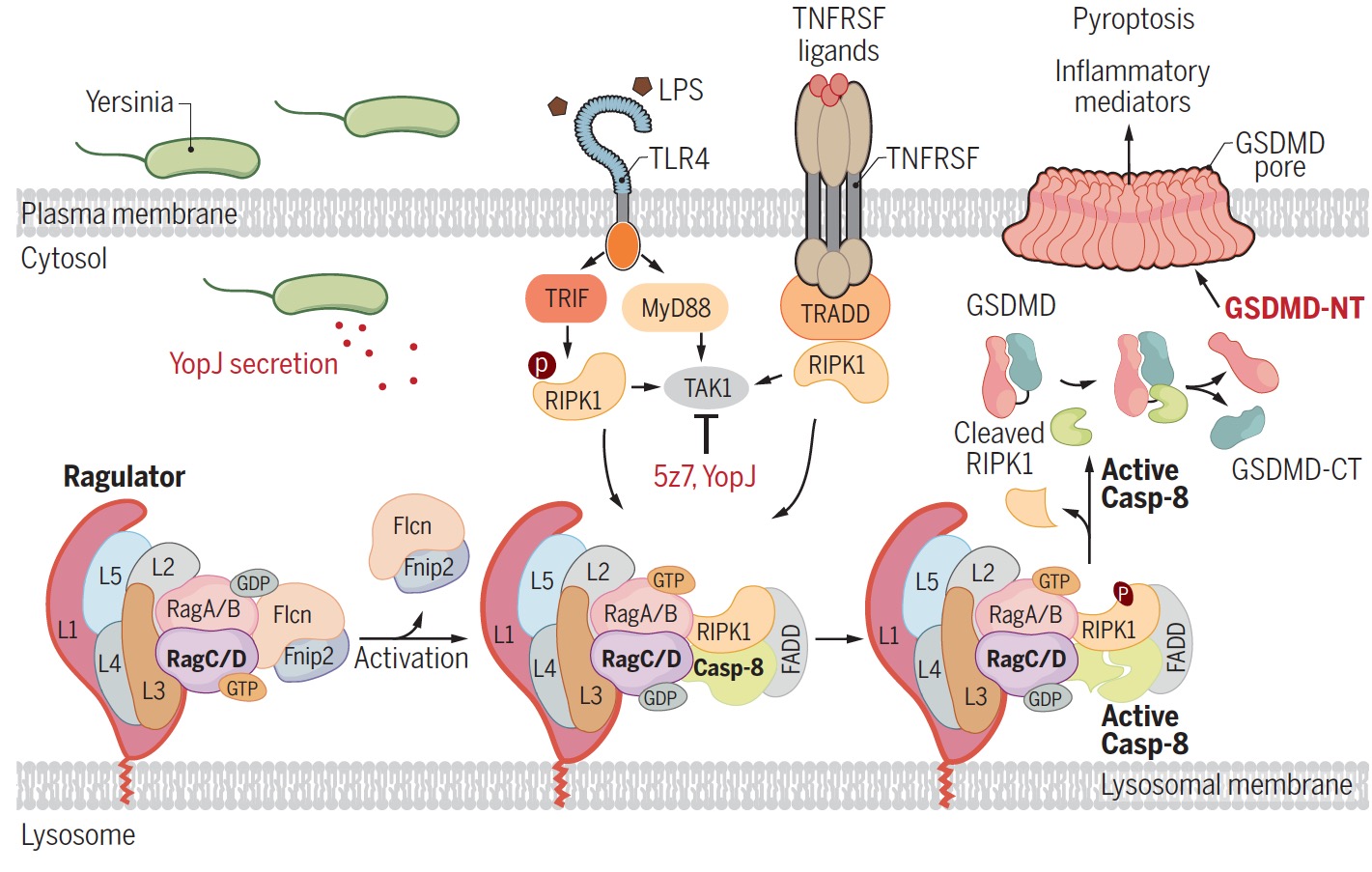
模式图:在耶尔森菌感染过程中,Rag-Ragulator作为一个功能性平台招募并激活RIPK1与caspase-8,进而触发GSDMD的剪切活化及随后的细胞焦亡。
全文链接: https://science.sciencemag.org/content/372/6549/eabg0269
附:中科院上海巴斯德所刘星课题组介绍:
中科院上海巴斯德所刘星课题组一直围绕病原体感染引起的机体免疫应答调控机制研究,探索病原微生物致病机理以及宿主细胞抵御病原体入侵的关键免疫规律,旨在为相关感染性疾病如脓毒症、自身免疫性疾病以及癌症的精准治疗提供新的药物靶点和治疗策略(http://sourcedb.shanghaipasteur.cas.cn/zw/kydw/yjzz/201804/t20180411_4995080.html)。刘星研究员在其所属研究领域取得诸多重要原创性成果,发表高水平SCI学术论文30余篇,其中以第一或通讯作者身份在Nature, Science, Cell, Nature Immunology, Immunity, Nature Reviews Drug Discovery等杂志发表论文20余篇,他引3000余次。作为一支年轻朝气、热爱科研、勇于挑战、团结协作的科研创新团队,课题组热忱欢迎有理想、有激情、踏实认真并乐于探索病原微生物及免疫未知世界的博士后、博士及研究生联系加入!
参考文献:
1. Shi, J., Gao, W. & Shao, F. Pyroptosis: Gasdermin-Mediated Programmed Necrotic Cell Death. Trends Biochem Sci 42, 245-254, doi:10.1016/j.tibs.2016.10.004 (2017).
2. Liu, X., Xia, S., Zhang, Z., Wu, H. & Lieberman, J. Channelling inflammation: gasdermins in physiology and disease. Nat Rev Drug Discov 20, 384-405, doi:10.1038/s41573-021-00154-z (2021).
3. Ruan, J., Xia, S., Liu, X., Lieberman, J. & Wu, H. Cryo-EM structure of the gasdermin A3 membrane pore. Nature 557, 62-67, doi:10.1038/s41586-018-0058-6 (2018).
4. Zhang, Z. et al. Gasdermin E suppresses tumour growth by activating anti-tumour immunity. Nature 579, 415-420, doi:10.1038/s41586-020-2071-9 (2020).
5. Liu, X. & Lieberman, J. Knocking 'em Dead: Pore-Forming Proteins in Immune Defense. Annu Rev Immunol 38, 455-485, doi:10.1146/annurev-immunol-111319-023800 (2020).
6. Shi, J. et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature 526, 660-665, doi:10.1038/nature15514 (2015).
7. Ding, J. et al. Pore-forming activity and structural autoinhibition of the gasdermin family. Nature 535, 111-116, doi:10.1038/nature18590 (2016).
8. Liu, X. et al. Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores. Nature 535, 153-158, doi:10.1038/nature18629 (2016).
9. Hu, J. J. et al. FDA-approved disulfiram inhibits pyroptosis by blocking gasdermin D pore formation. Nat Immunol 21, 736-745, doi:10.1038/s41590-020-0669-6 (2020).
10. Xia, S. et al. Gasdermin D pore structure reveals preferential release of mature interleukin-1. Nature, doi:10.1038/s41586-021-03478-3 (2021).
11. Orning, P. et al. Pathogen blockade of TAK1 triggers caspase-8-dependent cleavage of gasdermin D and cell death. Science 362, 1064-1069, doi:10.1126/science.aau2818 (2018).
12. Sarhan, J. et al. Caspase-8 induces cleavage of gasdermin D to elicit pyroptosis during Yersinia infection. Proc Natl Acad Sci U S A 115, E10888-E10897, doi:10.1073/pnas.1809548115 (2018).
(责编:黄萍)
附件下载: