2月22日,国际学术期刊Journal of virology在线发表了中国科学院上海巴斯德研究所金侠研究组和生物化学与细胞生物学研究所王琛研究组共同完成的最新研究成果“ER蛋白SCAP对登革病毒NS2B3的抑制作用及其机理”(ER protein SCAP inhibits Dengue virus NS2B3 protease by suppressing its K27-linked polyubiquitylation)。
登革病毒是近年来传播最为迅速的蚊媒病毒之一,它感染人体后可造成登革热、登革出血热及登革休克综合症。全球超过1/3的人群存在被感染的危险,每年的感染人数估计达到3.9亿,被报道的重症感染病例约为100万例,其中2-5%为致死病例。尽管登革病毒在超过125个热带和亚热带国家或地区流行,但尚无针对登革病毒的特异抗病毒药物和有效疫苗。
登革病毒是正链RNA病毒,由一个编码框翻译成一条3000多个氨基酸的前体蛋白,并由宿主蛋白酶和病毒蛋白酶—NS2B3剪切成三个结构蛋白和七个非结构蛋白。NS2B3在早前的研究中被证实可以剪切宿主的抗病毒蛋白STING,这一剪切过程被认为可协助病毒的免疫逃逸。然而,由于登革病毒的感染不激活经典的STING-IFN通路,NS2B3对STING的切割是否通过其他机制来影响宿主的抗病毒免疫是尚待解决的问题,NS2B3与STING相互作用和上下游的机制也亟待阐明和完善。王琛研究组曾发现SCAP蛋白可与STING蛋白结合,并正调控STING下游的信号通路,抑制DNA病毒的感染。SCAP蛋白是否也通过STING参与了RNA病毒的天然免疫尚不清楚。为了解相关机制,王琛研究员及其博士研究生柳恒、张乐乐与金侠研究员及其助理研究员孙瑾对NS2B3、SCAP及STING的相互关系进行了合作研究。
研究证实,通过在细胞感染模型中过表达和敲低SCAP和STING蛋白,SCAP具有同STING类似的抑制登革病毒复制的功能。同时研究发现,通过泛素化功能实验,NS2B3蛋白酶的组成NS3存在K27位的泛素化修饰,这一泛素化修饰协助NS2B招募NS3至内质网上,形成复合体NS2B3,并使位于NS3上的蛋白酶功能域活化,从而行使对STING的切割。随后,利用co-IP等技术,研究进一步发现SCAP蛋白可通过与STING蛋白竞争性结合NS2B,拮抗NS2B3复合物对STING的切割。另一方面,SCAP与NS2B3的结合可削弱NS3的泛素化,减弱NS2B同NS3的结合,进一步减弱NS2B3的蛋白酶功能,从而抑制NS2B3对STING的切割。这一研究首次揭示了SCAP通过阻止登革病毒NS2B3对STING的切割促进细胞的抗病毒天然免疫,是一种抗病毒蛋白。此外,该项研究成果也为登革感染的抗病毒治疗提供了一种潜在的策略。
该项研究得到国家自然科学基金及国家科学技术部经费资助。上海巴斯德研究所王建华研究员、中南大学夏赞贤教授、美国CDC的Claire Huang博士及McGill University的John Hiscott博士和Rongtuan Lin博士在关键材料和方法方面给予了大力协助。
全文链接:
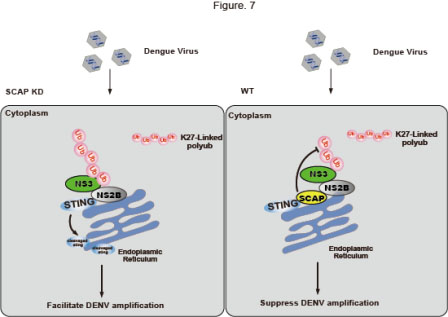
SCAP抑制登革病毒感染的机制模式图
附件下载: