PNAS丨酒亚明课题组揭示宿主细胞中间丝在寨卡病毒感染中的双重作用
2月22日,中国科学院上海巴斯德研究所酒亚明课题组在国际期刊PNAS发表了题为“Host cytoskeletal vimentin serves as a structural organizer and an RNA-binding protein regulator to facilitate Zika viral replication”的文章,该研究利用多种显微成像技术和组学分析,首次阐述了中间丝波形蛋白vimentin在寨卡病毒感染中的物理空间支撑与生物功能调控的双重作用。

寨卡病毒(Zika virus, ZIKV)是带包膜的单链正义RNA的黄病毒属病毒,因其感染会导致新生儿小头畸形、格林-巴利综合征等神经性疾病而被广泛关注(1-4)。ZIKV进入胞内后会在内质网膜进行复制,产生大量双链RNA、病毒基因组RNA和病毒蛋白,这些病毒组分和被劫持的宿主因子一起在核周聚集形成病毒复制工厂以提供高效的病毒复制(5-7),但是在此过程中发生剧烈重构的宿主细胞骨架发挥怎样的生物功能尚不清楚。
细胞骨架包括微丝、微管和中间丝,三者互相交织形成网络为细胞内提供机械支撑,参与细胞器定位、物质运输、信号传导等重要生物过程(8,9)。波形蛋白(vimentin filaments)属于细胞骨架中间丝,主要围绕细胞核向细胞边缘辐射状分布。近年来一些研究发现vimentin filaments在病毒感染中会发生重构向核周聚集,但是其在ZIKV感染过程中的动态变化及其生物功能尚不清楚。除此之外,细胞骨架蛋白还能参与调节胞内转录翻译机器(10)。但是中间丝vimentin与胞内转录翻译机器之间的物理空间和生物功能上的关系尚不清楚,尤其在病毒感染情况下,vimentin filaments与病毒复制工厂形成的联系完全未知。
研究人员首先利用共聚焦显微镜、活细胞实时观察、超高分辨率显微镜和电镜等生物成像技术观察到随着ZIKV感染时间的延长,细胞内vimentin filaments逐渐向核周聚集,形成笼状结构以包裹病毒复制工厂组分如dsRNA、NS4B和Env (图1),内源表达病毒蛋白Env也能诱导vimentin filaments产生类似的现象。
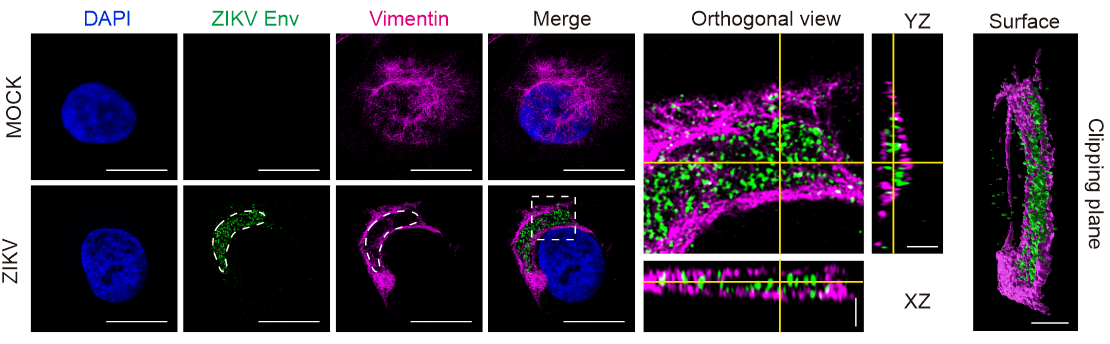
图1. Vimentin filaments围绕ZIKV病毒蛋白形成笼状结构
之前就有一些文章报道了vimentin filaments在多种病毒感染中均会出现类似重构现象(11-17),为了进一步研究这一变化的具体意义和机制,研究人员利用CRISPR/Cas9技术敲除人骨肉瘤细胞系U2OS和人肝癌细胞系Huh7中的vimentin后,发现病毒复制工厂组分NS4B、Env或dsRNA的胞内定位由核周聚集变为呈多块分散 ,并使病毒RNA复制、蛋白合成、子代病毒产生量和整体感染率都显著降低。有趣的是,只有在敲除细胞中回补全长vimentin才能使病毒复制工厂在被vimentin filaments的包裹下重新向核周聚集成团,回补只能形成八聚体(unit length of filaments,ULF)不能成丝的vimentin不能挽救其分散表型。除此之外,研究人员发现ZIKV感染后细胞内另一中间丝巢蛋白(nestin filaments)和波形蛋白一起发生了向病毒复制工厂聚集的变构,但是单敲除nestin基因并不影响ZIKV的复制,而单敲除vimentin不仅影响nestin的表达还影响病毒复制工厂的定位。这些结果表明vimentin保证了ZIKV复制工厂的高密度核周聚集,是病毒高效感染的必要条件,并且其功能在细胞多种中间丝中具备独特性和重要性。
为了进一步研究vimentin具体影响了ZIKV病毒感染的哪些步骤,研究人员在野生型和vimentin敲除细胞系中做了不同感染时间点实验,和病毒结合/进入细胞实验,结果发现敲除vimentin并不影响ZIKV结合或进入细胞,但会使病毒蛋白积累量持续低于野生型细胞。为了辨别这种病毒蛋白的降低是合成减少还是降解增加,研究人员分别在两种细胞内过表达病毒Env-EGFP和NS4B-EGFP蛋白,并分别用蛋白合成抑制剂cyclohemide (CHX)、蛋白酶体抑制剂MG132、溶酶体抑制剂NH4Cl处理,结果发现vimentin影响了病毒蛋白合成而非降解。
因为vimentin filaments正常情况下和ZIKV感染情况下的细胞内定位与内质网高度重合,且敲除vimentin使内质网分布更加扩散,提示vimenitn和内质网之间存在重要联系。研究人员利用质谱结果进行蛋白质组学分析发现胞内vimentin和大量位于内质网的RNA结合蛋白(RNA-binding proteins, RBPs)存在互作。进一步RNA测序组学分析发现,相对于野生型细胞,vimentin敲除细胞感染病毒后大量内质网相关的具备双链RNA结合功能和转录调节功能的基因表达发生显著下调,这些结果进一步印证了vimentin参与寨卡病毒RNA复制过程。综合两种组学分析结果,研究人员将目光聚焦于内质网上一跨膜蛋白核糖体结合蛋白1(ribosome-binding protein 1, RRBP1),并利用蛋白质体外结合实验(pull-down assay)验证了vimentin和RRBP1相互作用。在2019年就有文章报道RRBP1能直接结合病毒RNA从而帮助黄病毒复制,缺失RRBP1基因使胞内寨卡病毒RNA水平下降约40%(18)。 为了探究vimentin和RRBP1分子在ZIKV感染中的关系,作者在野生型细胞和vimentin敲除细胞中分别敲低RRBP1基因表达,观察两者胞内表达和定位情况,并对比ZIKV在其中的感染情况。结果发现缺失vimentin使RRBP1在mRNA和蛋白质水平均下降约50%,且RRBP1和内质网信号在胞内定位更加分散,出现了类似病毒复制工厂分散的现象,虽然RRBP1与内质网共定位关系不变,但RRBP1与ZIKV dsRNA共定位水平显著下降。这说明vimentin对于ZIKV感染后内质网的精细变构发挥重要作用,使病毒复制工厂保持致密结构,并聚集其余宿主分子如参与病毒转录翻译的ER相关蛋白使其保持高效复制。反之RRBP1敲低却不影响vimentin的转录翻译水平和胞内定位。单独敲除vimentin使病毒复制下降的水平远大于单独敲除RRBP1,且和双敲除的抑制效率类似,这表明vimentin可能作为RRBP1上游分子调控其参与病毒RNA复制过程。
纵观整篇文章,这项研究揭示了在受到寨卡病毒感染后,细胞中间丝波形蛋白网络会逐渐向核周聚集形成笼状结构包裹病毒复制工厂,汇聚重要的宿主因子和病毒组分,与众多内质网蛋白互作如RRBP1以促进病毒RNA复制,从而同时在物理空间和生物功能上帮助病毒在胞内形成完整致密的病毒复制工厂以促进病毒产生,这提示vimentin可作为ZIKV感染治疗的潜在宿主靶点。

图2. Vimentin filaments在ZIKV病毒感染过程中作为‘结构支撑’和‘调节因子’的双重功能
中国科学院上海巴斯德研究所博士生张悦为该文章第一作者;中国科学院上海巴斯德研究所酒亚明研究员、复旦大学上海市公共卫生临床中心金侠教授为该文章的共同通讯作者;中国科学院生物物理研究所薛艳红研究员和中国科学院上海巴斯德研究所崔杰研究员为该文章的样品制备和数据收集提供了支持;该研究也得到了芬兰 Abo Akademi University的John E. Eriksson教授、中国科学院分子细胞科学卓越创新中心的鲍岚研究员与朱学良研究员的支持和帮助。
【实验室简介】
中科院上海巴斯德研究所酒亚明课题组一直围绕细胞骨架调控肿瘤转移和病原体感染这两大类疾病研究,优化并融合了一系列先进光学成像技术和病毒细菌感染实验体系,从细胞骨架、信号转导和病原体宿主互作等多个角度,深入解析了细胞骨架与疾病的分子机理,旨在为癌症以及相关感染性疾病的精准治疗提供新理论、药物靶点和治疗策略。酒亚明研究员围绕上述工作取得一系列重要原创性成果,发表高水平SCI学术论文40余篇,近期研究成果以通讯作者在PNAS, JCB, Current Biology等高水平杂志发表。作为一支朝气蓬勃、热爱科学、团结协作的科研团队,课题组热忱欢迎优秀的博士后、博士及研究生联系加入,联系方式ymjiu@ips.ac.cn。
原文链接:https://www.pnas.org/content/119/8/e2113909119
附件下载: