上海巴斯德所联合复旦大学和上海科技大学揭示恶性疟原虫编码超大膜蛋白VAR2CSA识别胎盘及肿瘤细胞的分子机制
10月19日,国际学术期刊Cell Discovery在线发表了中国科学院上海巴斯德研究所王岚峰课题组、江陆斌课题组、复旦大学陈振国课题组及上海科技大学杨秀娜和高岩副研究员的合作研究论文:The molecular mechanism of cytoadherence to placental or tumor cells through VAR2CSA from Plasmodium falciparum。

疟疾是一种由疟原虫引起,经按蚊传播的虫媒病。全球范围内,每年约2亿多人感染疟疾,导致40多万人死亡。此外,耐药虫株在不断出现,使得疟疾依然是世界上危害最大的寄生虫病。疟疾高发地区的女性在怀孕期间对疟原虫高度易感,且容易发展成凶险型胎盘相关疟疾(PAM),给孕妇及胎儿带来致命性的伤害。疟原虫编码的表达于被感染红细胞表面的VAR2CSA蛋白在PAM发生中起重要作用。疟原虫通过VAR2CSA蛋白与胎盘胚胎滋养层细胞表面的硫酸软骨素A(CSA)结合,使被感染红细胞大量粘附在胎盘,来逃避宿主的免疫识别。阻断VAR2CSA对胎盘的粘附,可以有效降低孕妇感染的风险。此外,因为恶性肿瘤组织具有和胎盘组织相同的糖基化修饰,所以VAR2CSA蛋白可以与许多不同类型的肿瘤细胞特异性结合,针对VAR2CSA的结构和功能研究也可以为肿瘤诊断与靶向性治疗提供新方案。VAR2CSA是单次跨膜的膜蛋白,在被感染红细胞表面的表达丰度较低,且全长分子量超过350 kDa,使得全长蛋白的制备难度很大,因而自该蛋白被鉴定近20年来,相关研究基本停留在各类截短突变体上。
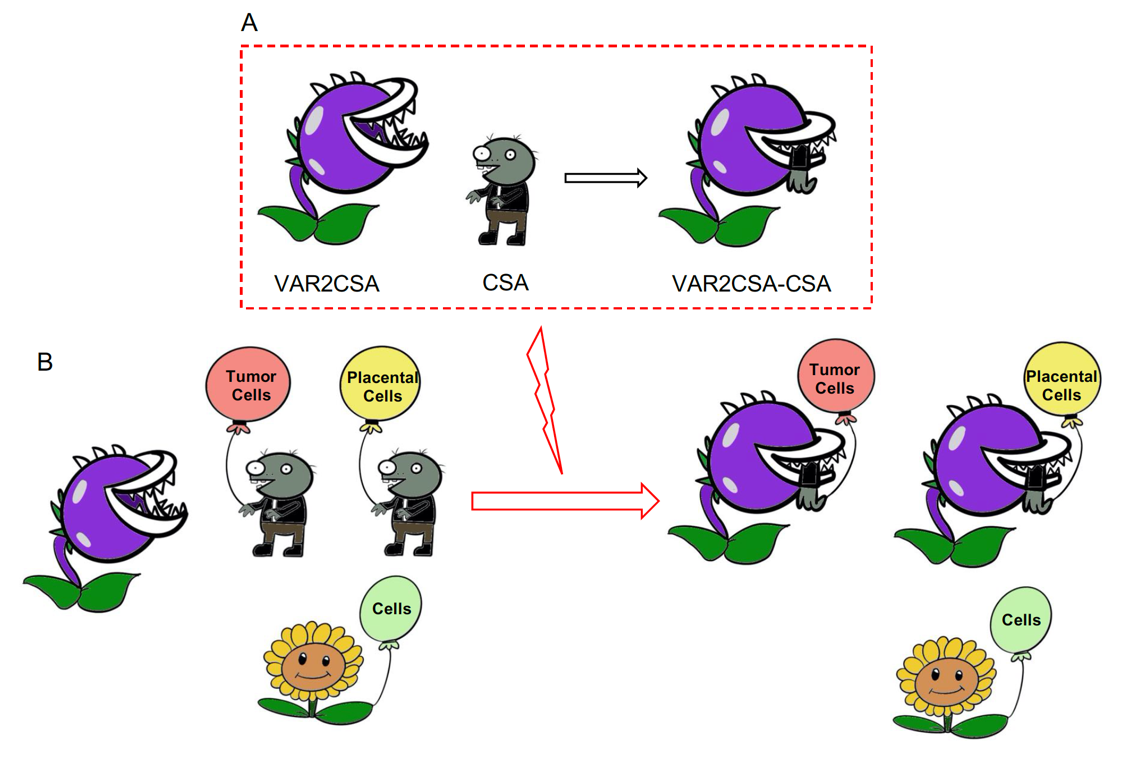
图示: VAR2CSA 特异性识别胎盘细胞和肿瘤细胞的模型
本研究中,研究者利用杆状病毒-昆虫细胞表达系统制备了恶性疟原虫VAR2CSA胞外区的样品(306 kDa)。借助冷冻电镜单颗粒技术,解析了VAR2CSA胞外域的三维结构,分辨率为3.6? 。VAR2CSA胞外域DBL1X-DBL4ε结构域组成了一个稳定的核心区域,柔性较大的DBL5ε和DBL6ε结构域游离在核心区域外,组成了arm区。同时,研究者也成功解析了VAR2CSA胞外域-CSA复合物的结构,分辨率为3.4? 。与Apo蛋白相比,复合物中DBL4ε的构象基本保持一致,但DBL1X和DBL2X在CSA结合到正电荷口袋后,构象发生显著变化,将正电荷口袋紧缩,从而将CSA分子稳定地捕获在由NTS,DBL1X,DBL2X和DBL4ε形成的正电荷口袋中。依据结构信息,我们选取底物结合口袋中DBL2X上的9个关键氨基酸进行突变,利用液相色谱层析,生物膜干涉技术,共聚焦免疫荧光显微技术等多种技术手段,证明了突变体失去了与纯化的CSA、胎盘及肿瘤细胞结合的能力。最终系统地阐明了恶性疟原虫VAR2CSA特异性结合胎盘细胞及肿瘤细胞的详细分子机制。该研究成果将有助于精准设计疟疾疫苗,为防治PAM提供科学依据,同时为开发高效的恶性肿瘤的诊断和靶向性治疗方法提供理论基础。
中科院上海巴斯德研究所博士研究生王伟伟和王肇宁,上海科技大学杨秀娜副研究员和高岩副研究员,复旦大学博士研究生张翔为本文的共同第一作者。上海巴斯德研究所王岚峰研究员和江陆斌研究员,以及复旦大学陈振国研究员为本文的通讯作者。该研究得到国家科技部重大专项,中国科学院战略性先导科技专项(先导B),国家自然科学基金, 上海市科技重大专项等项目的资助。冷冻电镜相关的研究得到复旦大学,上海科技大学冷冻电镜中心的大力支持。
文献:The molecular mechanism of cytoadherence to placental or tumor cells through VAR2CSA from Plasmodium falciparum
链接:https://www.nature.com/articles/s41421-021-00324-8
附件下载: