黄忠课题组合作研发针对肠道病毒D68型的高效单抗疗法并揭示其作用机制
5月18日,国际著名学术期刊Nature Communications在线发表了中国科学院上海巴斯德研究所黄忠课题组和中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)丛尧课题组、广州市妇女儿童医疗中心龚四堂课题组的合作研究论文“Functional and structural characterization of a two-MAb cocktail for delayed treatment of enterovirus D68 infections”。

肠道病毒D68型(EV-D68)是小RNA病毒科肠道病毒属D族成员。除原型株Fermon外,现在流行的EV-D68毒株可分为A-D四个基因型别。EV-D68与儿童中的严重呼吸道感染、急性迟缓性脊髓炎(AFM)密切相关。在过去的十年中,EV-D68已在全世界范围内流行,引起了众多的暴发和散发。显然,EV-D68已成为重要的全球公共健康问题。然而目前尚无疫苗和药物。
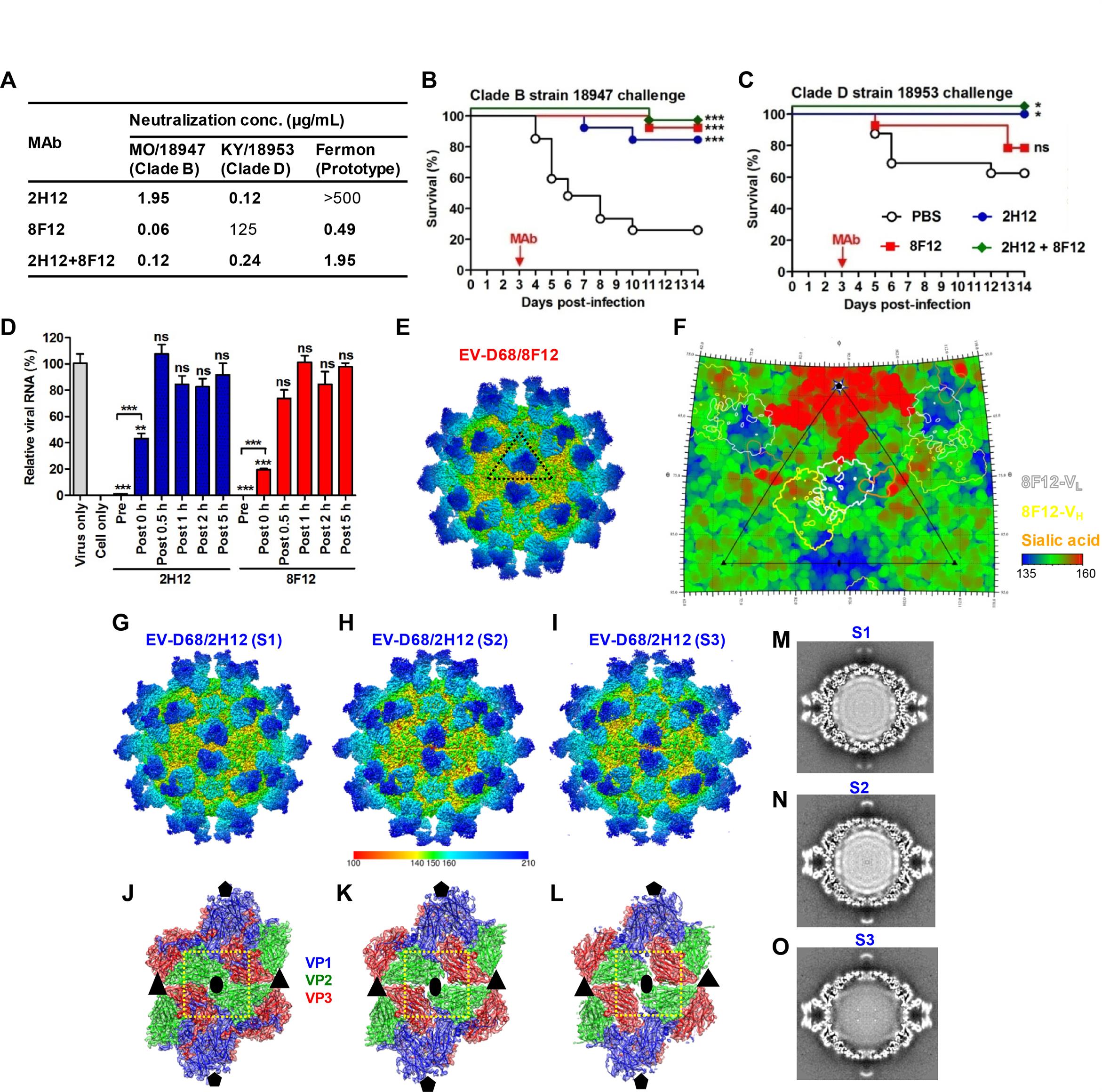
科研人员针对EV-D68病毒样颗粒制备了两个单抗2H12和8F12。这两个单抗在抗原结合上有明显的偏好性,2H12更高效地结合免疫原—病毒样颗粒(空心的膨胀构象),而单抗8F12更高效地结合成熟病毒颗粒(实心的紧凑构象)。2H12和8F12在中和不同型别EV-D68毒株上也有明显偏好性,而双抗体组合表现出平衡、高效的中和(图A)。此外,双抗体组合可以在小鼠中赋予比单个单抗更广谱的保护,并且在感染发病时(3天)给药依然有效(图B-C)。研究表明两个抗体主要在病毒吸附细胞前起作用(图D),并能阻止病毒与唾液酸受体作用介导的红细胞凝集的发生,提示抗体结合可以阻断受体结合。
抗体8F12与EV-D68成熟病毒复合物的冷冻电镜结构表明,8F12与病毒的峡谷区(canyon)结合,进而对唾液酸受体结合产生空间位阻,并且这个区域是未报道过的EV-D68抗原位点(图E-F)。此外,在对抗体2H12与EV-D68成熟病毒复合体进行冷冻电镜研究过程中,发现2H12结合可以使一部分EV-D68病毒颗粒碎掉,暗示2H12可以损害病毒颗粒完整性,影响其感染性。对EV-D68/2H12的进一步三维分组和重构获得了三个不同的构象状态,命名为S1、S2和S3(图G-I)。S1中的病毒颗粒采用成熟病毒构象(图G,J),与8F12复合物中的结构相似。与S1相比,S2和S3中的病毒存在明显的构象差异,包括病毒颗粒的膨胀、二次轴空洞的打开、病毒RNA基因组的减少(S3状态)(图G-O),说明2H12结合可以触发过早的病毒脱衣壳,影响其感染性。S3状态是一种未报道过的脱衣壳中间体,可能发生在从135S A颗粒(带有病毒RNA的经典脱衣壳中间体)到80S空颗粒(没有基因组RNA)的过渡中。
综上,本研究揭示了一对独特的EV-D68中和性单抗,它们表位相似,但结合特性、中和特性、作用机制不同。这对抗体的组合可作为抗人类中EV-D68感染的广谱治疗剂进行进一步开发,具有重要的理论意义和临床转化价值。
图例:
(A)单抗2H12、8F12及其组合的中和谱差异。
(B-C)单抗对感染EV-D68 B型和D型临床株的小鼠的治疗功效。
(D)病毒吸附细胞前和吸附后的抗体抑制实验,提示单抗主要在吸附前阶段发挥作用。
(E)EV-D68/8F12复合物的冷冻电镜密度图。
(F)二维投影说明8F12在病毒表面上的“足印”,与唾液酸受体的结合位点有重叠。
(G-I)EV-D68/2H12的冷冻电镜结构,包括三种不同状态(即S1、S2和S3),说明2H12可以诱导病毒变构。
(J-L)EV-D68/2H12三种状态病毒衣壳的二次轴区域的结构差异,显示S2和S3二次轴孔洞被打开。
(M-O)EV-D68/2H12三种状态密度图的中央切片,显示S3所含病毒RNA量显著降低,提示抗体2H12可以诱导病毒提前脱衣壳。
上海巴斯德所副研究员张超,中国科学院分子细胞科学卓越创新中心博士研究生徐聪,上海巴斯德所毕业博士生代文龙为本文并列第一作者。上海巴斯德所黄忠研究员、中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)丛尧研究员、广州市妇女儿童医疗中心龚四堂教授为本文共同通讯作者。该研究得到了中国科学院战略性先导科技专项(先导B)、国家科技部重点研发计划、传染病国家重大专项、国家自然科学基金、上海市科技重大专项及上海市优秀学术带头人、中国科学院青年创新促进会等项目的资金支持。此外,该研究还得到国家蛋白质科学研究(上海)设施的冷冻电镜系统的大力协助。
附件下载: