NSMB | 王程远研究组合作揭示RfaH介导细菌毒力因子表达的分子机制
近日,中国科学院上海免疫与感染研究所王程远研究组联合美国罗格斯大学Richard Ebright团队在Nature Structural & Molecular Biology上发表了题为“Structural basis of RfaH-mediated transcription-translation coupling”的研究论文,该研究聚焦致病细菌重要毒力因子调控蛋白RfaH,揭示了RfaH通过介导细菌转录翻译偶联过程调控基因表达的分子机制。

RfaH是细菌重要的毒力因子表达调控蛋白,能介导大肠杆菌、肺炎克雷伯菌、沙门氏菌等革兰氏阴性致病菌中脂多糖、荚膜多糖、III型分泌系统、溶血素等毒力基因的表达,因此是开发抗生素和细菌疫苗的重要靶点。研究发现,RfaH是细菌NusG家族蛋白的同源蛋白,能特异性识别毒力基因中的ops(operon polarity suppressor)序列,和NusG竞争性结合RNA聚合酶,并最终完成对目的基因的转录激活。另一方面,这些毒力基因同时又受到Rho因子依赖型转录终止机制的抑制。在细菌中RfaH是如何协调转录延伸与Rho因子依赖型转录终止的分子机制仍不明确。
王程远研究组在前期的研究过程中解析了转录因子NusG介导细菌转录翻译偶联(Science 2020)、Rho因子依赖型转录终止(Nature 2023)的分子机制以及Rof抑制Rho因子依赖型转录终止(Nature Communications 2024)的调控机理,提出了转录翻译偶联与Rho因子依赖型转录终止机制相互协调,共同响应环境压力信号的分子模型。本研究在此基础上,继续探索RfaH在转录翻译偶联过程中可能的分子调控机制。

图1:转录翻译偶联与Rho因子依赖型转录终止机制协同调控细菌响应环境信号模型
本研究通过体外组装结合实验,先证明了RfaH能与核糖体、RNA聚合酶直接相互作用。之后又通过单颗粒冷冻电镜方法解析了一系列RfaH介导(或RfaH/NusA共同介导)的转录翻译偶联复合体结构(分辨率3.2-5.7Å),证明了如下机制:
1. RNA聚合酶与核糖体之间信使mRNA的长度不同,会形成两种不同的转录翻译偶联复合体,分别为转录翻译偶联复合体A以及转录翻译偶联复合体B,RfaH只在复合体B中同时连接RNA聚合酶与核糖体;
2. 在转录翻译偶联复合体B中RfaH转录因子通过其N端NGN结构域与RNA聚合酶结合;通过其C端KOW结构域与核糖体S10蛋白结合;
3. 在转录翻译偶联复合体B中,NusA能进一步稳定转录翻译偶联过程;
4. 与NusG介导的转录翻译偶联复合体相比较,RfaH介导的复合体中,RNA聚合酶相对核糖体更加稳定,有利于翻译的起始与延伸;
5. RfaH介导形成的转录翻译偶联复合体能通过空间位阻,抑制Rho因子识别并结合信使RNA,抑制Rho因子依赖型转录终止。
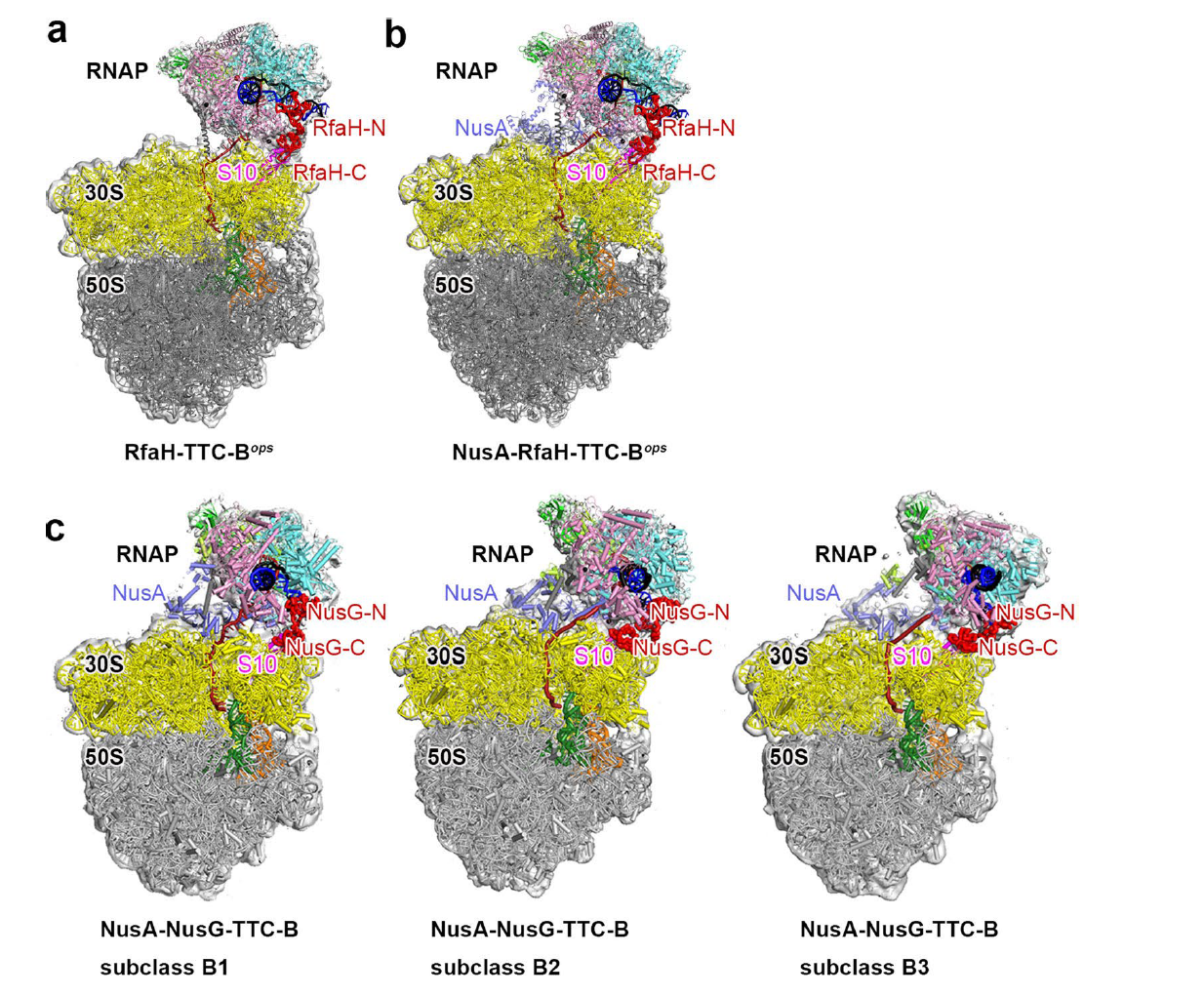
图2:RfaH/NusG介导的转录翻译偶联复合体结构比较
本研究首次解析了RfaH介导转录翻译偶联复合体结构,阐明了RfaH促进翻译起始、延伸过程,抑制Rho因子依赖型转录终止的分子机制,完善了NusG家族蛋白参与细菌转录的调控模型,为进一步研究致病菌毒力因子表达调控以及靶向转录过程的抗生素、疫苗开发提供了研究基础。
中国科学院上海免疫与感染研究所王程远研究员为本论文的共同第一作者、博士后张晶为论文的共同作者。本研究获得了国家自然科学基金面上项目、上海市2023年度“科技创新行动计划”基础研究等项目的支持。
原文链接:https://www.nature.com/articles/s41594-024-01372-w
附件下载: