4月11日,国际学术期刊 Cell Discovery 在线发表了中国科学院上海巴斯德研究所苏枭研究组最新研究成果“迷走神经-脾脏协同调控急性肺部感染损伤的分子机制”(Signals of vagal circuits engaging with AKT1 in α7 nAChR+CD11b+ cells lessen E. coli or LPS‐induced acute inflammatory injury)。
急性肺损伤可以由感染(细菌、病毒等)、酸吸入、创伤等因素诱发,病理表现为肺内严重的炎症反应、炎症细胞浸润、肺上皮和内皮细胞损伤以及气血屏障的失调。急性肺损伤患者即便有重症支持疗法,死亡率仍在30~40%以上。神经系统如何调控感染、炎症和免疫是一个新兴的交叉学科研究热点,许多重大科学问题需要回答。
经典的迷走神经对炎症反应的调控通过胆碱能抗炎症通路实现。该通路认为迷走神经释放递质乙酰胆碱(ACh)可以激活α7 nAChR(ACh受体一种亚型),抑制炎症细胞尤其是单核/巨噬细胞的核因子kB(NF-kB)激活,减少肿瘤坏死因子(TNF-α)和高迁移率族蛋白1(HMGB1)等促炎症因子的生成。脾脏是该通路的功能枢纽。由于脾脏对接体循环,对全身血液有滤过作用,因此这种调控对解释全身性炎症反应起着重要作用。肺脏是个对外界开放的器官,肺部感染、炎症产生的炎症因子,一般情况下不进入体循环。因此,肺副交感神经炎症反射弧对肺部病原识别和感染、炎症的控制至关重要。
肺副交感神经炎症反射弧理论是指迷走神经可以支配到远端气道,甚至肺泡,支配气道传感器。迷走神经依靠气道传感器或病原体识别受体感知肺内病原和炎症的变化。感知的信息可以通过迷走神经传入支传递到桥脑的孤束核(NTS)。整合之后通过肺迷走神经传出支分泌ACh,激活肺部炎症细胞α7 nAChR,抑制NF-kB活化和下调炎症细胞因子水平,减轻肺部炎症和损伤。因此切断迷走神经和敲除α7 nAChR可以加重脂多糖(LPS)或大肠杆菌(E. coli)诱导的急性肺损伤。
苏枭研究员一直从事迷走神经对急性肺损伤调控机制研究。他提出肺副交感神经炎症反射弧调控肺部感染免疫的理论,带领博士研究生赵才琦、杨茜等研究组成员,在美国加州大学旧金山分校Michael A. Matthay教授的帮助下,发现了迷走神经-脾脏协同调控急性肺部感染、炎症反应的信号机制(见附图)。 研究组发现LPS或大肠杆菌诱导的急性肺损伤小鼠模型,切除迷走神经可以显著增加脾脏α7 nAChR+CD11b+细胞(CD11b是炎症细胞-单核细胞和中性粒细胞的表面标记)游出和增加肺部α7 nAChR+CD11b+细胞的募集,加重肺部炎症反应。给小鼠应用α7 nAChR激动剂可以纠正迷走神经切除的效应,抑制α7 nAChR+CD11b+细胞的脾脏游出和肺部募集,减轻肺部炎症反应。迷走神经可以通过激活α7 nAChR促进α7 nAChR+CD11b+细胞的蛋白激酶 B(AKT1)的丝氨酸473磷酸化,并抑制这些细胞的脾脏游出。骨髓的α7 nAChR+CD11b+细胞并不受该机制的影响。同样,敲除Akt1可以减少急性肺损伤时脾脏α7 nAChR+CD11b+细胞,相反增加肺α7 nAChR+CD11b+细胞,促进中性粒细胞浸润和加重LPS和大肠杆菌诱导急性肺损伤。迷走神经切除和敲除α7 nAChR和CD11b可以减少脾和支气管肺泡灌洗(BAL)Ly6CintGr1hi嗜中性粒细胞和Ly6Chi单核细胞的AKT1丝氨酸473磷酸化,促进嗜中性粒细胞和单核细胞向大肠杆菌损伤的肺部募集,加重大肠杆菌和LPS诱导的急性肺损伤。因此迷走神经促进α7 nAChR+ CD11b+细胞AKT1磷酸化,抑制脾脏炎症细胞动员和肺部募集,减轻大肠杆菌和LPS诱导急性肺损伤。迷走神经通过α7 nAChR调控AKT1磷酸化影响急性肺损伤发生、发展,为急性肺损伤的治疗提供了新的理论依据。
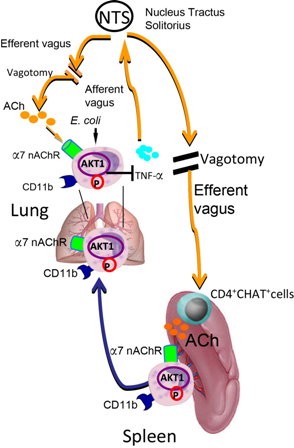
迷走神经-脾脏协同调控急性肺部感染、损伤的分子机制
附件下载: