9月7日,国际学术期刊Journal of Biological Chemistry在线发表了中国科学院上海巴斯德研究所王建华研究员与上海市第九人民医院王志良教授合作的最新研究成果,揭示了HIV-1破坏血-视网膜屏障、促进病原体侵染的分子机制。
人类视网膜居于眼球壁的内层,由血管内皮细胞、色素上皮细胞、神经元和小胶质细胞和巨噬细胞等组成的紧密连接复合体(称为血-视网膜屏障),严格控制溶质和流体的渗透性,保持眼部适宜的生理环境,并可防止病原体入侵。
有证据表明,眼部组织可成为艾滋病毒(HIV-1)的“贮存库”。HIV-1抗原或核酸可在眼内组织如视网膜血管内皮细胞及结膜组织中检测到。本课题的另一位合作者,北京协和医院的李太生教授,曾在HIV-1感染者包括抗逆转录病毒治疗病人的泪液中检测到病毒核酸(2011,AIDS);另外, HIV-1感染可引起视网膜炎、虹膜睫状体炎等眼部疾病,与眼部屏障破坏导致多种疱疹病毒如巨细胞病毒、水痘-带状疱疹病毒等入侵有关。王志良教授曾分析了787位华东地区HIV-1感染者,发现高达26.3%比例的感染者具有眼部疾病,而巨细胞病毒侵染占有10.6%的比例(2012,Am J Ophthalmol)。但其入侵机制尚未清楚。
上海市第九人民医院硕士研究生钱怡文和上海巴斯德研究所博士研究生李川在王建华研究员和王志良教授的共同指导下,分析了HIV-1入侵眼部组织的分子机制。研究发现,人视网膜色素上皮细胞表达一种称为DC-SIGN的C-型凝聚素,能够结合HIV-1包膜糖蛋白gp120,可导致细胞内NF-kappaB通路活化,诱导金属蛋白水解酶MMP2和MMP9的高表达,从而降解细胞间紧密结合蛋白如Occludin、JAM-2、Claudin-5以及胞内蛋白分子ZO-1,增强了血-视网膜屏障的通透性。该研究揭示了HIV-1入侵眼部组织的分子机制。
该研究可为分析其它病原体侵染眼部组织机制提供借鉴。如埃博拉可侵染眼部组织,病人治疗康复9周后,在血浆中已经检测不到病毒的情况下,却在房水中仍能检测到病毒颗粒(2015,N Engl J Med);最近报道,小鼠通过足垫皮下接种寨卡病毒后,在感染1周后眼部仍能检测到活的病毒颗粒(2016,Cell Rep)。埃博拉或寨卡病毒包膜糖蛋白是否可通过类似的机制侵染眼部组织值得进一步研究。
该研究得到国家基金委、科技部艾滋病和病毒性肝炎重大传染病防治专项、上海科学技术委员会及863计划等项目的资助。
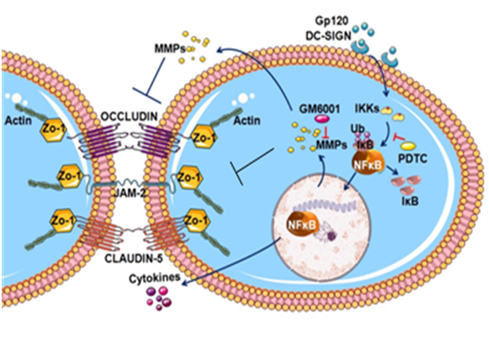
HIV-1结合人视网膜色素上皮细胞破坏细胞间紧密结合蛋白模式图
附件下载: