1月31日,中国科学院上海免疫与感染研究所孟广勋研究组与上海交通大学医学院附属新华医院刘辰莹课题组合作,在国际著名期刊Nature Immunology发表了题为“Short IL-18 generated by caspase-3 cleavage mobilizes NK cells to suppress tumor growth”的研究论文,首次揭示了肿瘤细胞内由Caspase-3切割产生的短形式IL-18(白细胞介素18)通过动员NK细胞抑制肿瘤发生发展的研究成果。

以CAR-T细胞疗法为代表的肿瘤免疫治疗策略近年来取得显著进展;然而多种实体瘤对肿瘤免疫治疗的响应率依然较低,迫切需要理解肿瘤的免疫逃逸机制,开发新的应对策略。CD8+T细胞和NK细胞是人体监视肿瘤的主要免疫细胞。作为天然免疫系统的关键组分,NK细胞免疫应答快、抗肿瘤范围广、通用性好、毒性低,成为抗癌治疗的新焦点。然而,肿瘤细胞通过特定基因的突变或沉默等多种方式逃避免疫系统的监视和攻击。IL-18在许多肿瘤细胞中表达降低,提示IL-18的缺失可能是肿瘤细胞逃避免疫攻击的重要机制。
IL-18首先以没有活性的前体形式产生,即Pro-IL-18,Caspase-1可将其切割为成熟形式分泌至细胞外,诱导免疫细胞的抗肿瘤反应,但该过程很容易被白介素18结合蛋白(IL-18BP)干扰。团队发现,肿瘤细胞内表达的IL-18发挥抑癌功能,但与其传统的成熟形式无关,而是通过Caspase-3切割产生的短形式IL-18实现的。短形式IL-18的丰度与结直肠癌患者临床样本中肿瘤的发展显著负相关。与成熟IL-18不同,短形式IL-18不会分泌到细胞外,而是进入细胞核,通过改变STAT1的磷酸化状态,促进ISG15的分泌从而强化NK细胞的抗肿瘤功能。综上,该研究发现IL-18被Caspase-3特异性切割后生成一种新型的功能片段,并阐明了其独特的抗肿瘤功能和机制,不仅拓展了对IL-18分子的生物学认识,还为肿瘤免疫治疗提供了新靶点,具有理论创新和应用潜力。
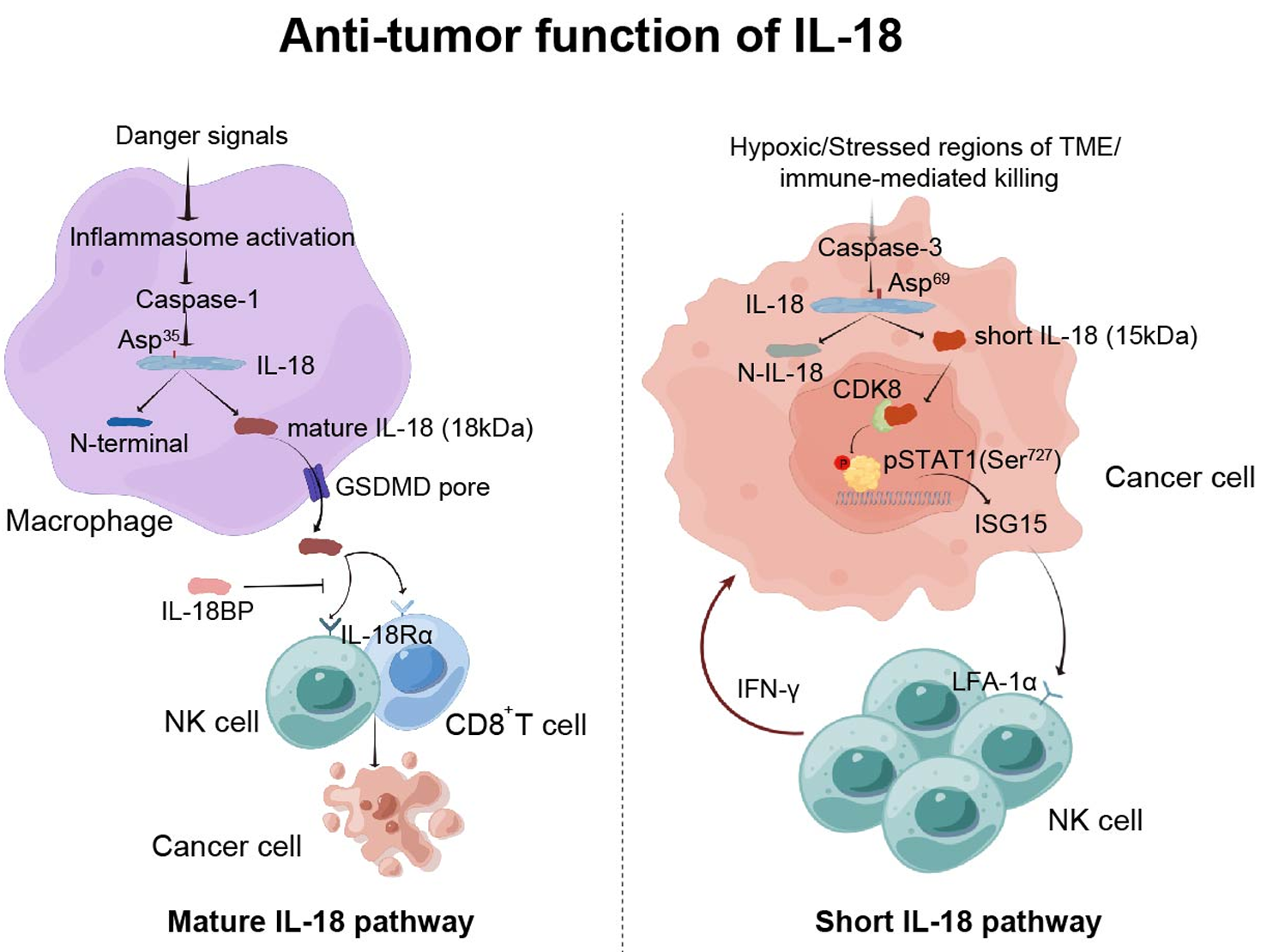
图:成熟IL-18和短形式IL-18的抗肿瘤机制对比图(Figdraw绘制)
原文链接:https://www.nature.com/articles/s41590-024-02074-7
【研究团队】
中国科学院上海免疫与感染研究所孟广勋研究员为该论文的通讯作者,上海交通大学医学院附属新华医院刘辰莹教授为共同通讯作者;中国科学院上海免疫与感染研究所博士后沈俊辰为论文第一作者,中国科学院上海免疫与感染研究所博士生张瑜和上海交通大学医学院附属新华医院博士生唐文博为论文共同第一作者。该工作得到了中国科学院战略性先导科技专项、国家自然科学基金、国家重点研发计划、上海市科技重大专项及上海市自然科学基金的支持。
附件下载: