5月22日,研究所邵孟乐课题组与南京大学甘振继课题组合作在国际学术期刊Nature Cell Biology发表了题为 Proteolytic rewiring of mitochondria by LONP1 directs cell identity switching of adipocytes 的研究论文。该研究发现依赖蛋白酶LONP1的线粒体蛋白水解重排能调控白色脂肪细胞的命运转变,揭示了高度调控的线粒体蛋白酶是细胞的关键感应纽带,将细胞外环境刺激、线粒体呼吸链复合物/代谢重塑与白色脂肪产热重塑过程中的细胞命运重编程有机联系起来。

众所周知,线粒体是细胞的能量工厂。同时,也是细胞代谢,天然免疫和细胞凋亡控制中心。线粒体广泛参与包括细胞命运决定和衰老等众多细胞生物学过程。因此,线粒体正常功能的维持需要精细的、多层次的质量监控系统。其中,进化上高度保守的线粒体蛋白酶是线粒体质量控制的第一道防线,但对于线粒体蛋白稳态控制的作用机制和生理功能却十分不清楚。近年来研究还发现线粒体蛋白酶通过执行高度调节的蛋白水解反应来调控线粒体功能,在线粒体可塑性调节过程中发挥关键作用。与此同时,人类线粒体蛋白酶的失活突变可导致多种遗传性疾病,并且在许多病理状态下(如:神经退行性疾病、代谢综合征和癌症)也观察到线粒体蛋白酶水解活性的降低。然而,人们对于线粒体蛋白稳态是否与细胞命运决定和衰老有内在关联仍然未知。
该研究综合应用遗传学、生物物理和生物化学等方法,进一步探究了线粒体蛋白降解系统对脂肪细胞命运转变的潜在调节功能。首先,研究人员通过 Mito-Timer 转基因小鼠及硫醇探针Tetraphenylethene maleimide (TPE-MI),可视化展示并定量揭示了产热刺激可特异性增强白色脂肪细胞中依赖蛋白酶LONP1的蛋白水解动态调节规律。同时,通过系列脂肪细胞特异性 LONP1功能缺失细胞和小鼠模型,发现了尽管成熟白色脂肪细胞仅含有少量的线粒体,但依赖LONP1控制的线粒体蛋白稳态是白色脂肪细胞米色化的先决条件(图例)。随后,研究人员利用“AdipoChaser”遗传谱系追踪系统,揭示了LONP1的失活显著削弱成熟白色脂肪细胞向米色脂肪细胞的命运转变(图例)。紧接着,运用TurboID的邻近标记技术寻找LONP1蛋白水解的底物。通过定量代谢组学方法对LONP1缺陷型或野生型米色脂肪细胞进行系统代谢物比较分析,发现并证明了脂肪细胞命运决定的全新机制:即LONP1通过特异性调节线粒体呼吸链复合物II关键组分SDHB的降解,来确保足够量的胞内琥珀酸水平,从而保障白色脂肪细胞向米色脂肪细胞的命运转变。进一步经过细胞生化和染色质免疫沉淀和测序(ChIP-seq)分析,发现受LONP1调节的脂肪细胞内琥珀酸与-酮戊二酸(-KG)的比例变化引发产热基因的组蛋白甲基化状态改变,从而调控白色脂肪细胞向米色脂肪细胞转变的基因重编程。最后,研究人员还发现在年老小鼠脂肪细胞中重新激活LONP1-琥珀酸通路可以恢复老年白色脂肪细胞向米色脂肪细胞转变的能力,并挽救老年小鼠适应性产热能力的下降。
邵孟乐研究员与南京大学甘振继教授为该篇论文的共同通讯作者,该研究得到了国家自然科学基金面上项目、上海市浦江人才计划和上海市市级科技重大专项等项目的支持。
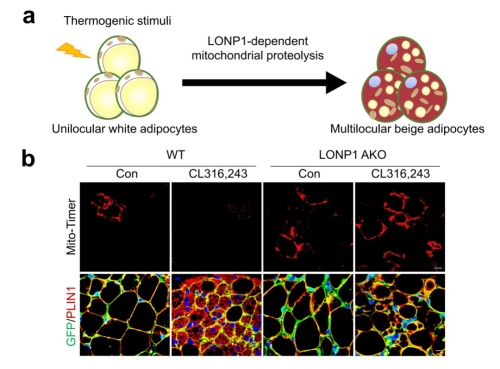
图例:依赖蛋白酶LONP1的线粒体蛋白降解系统控制白色脂肪细胞命运转变
附件下载: