Dev Cell | 酒亚明研究组揭秘巨噬细胞降解细胞外基质的新机制:中间丝网络的关键角色
2月13日,Developmental Cell在线发表了中国科学院上海免疫与感染研究所酒亚明研究组题为“Vimentin intermediate filaments coordinate actin stress fibers and podosomes to determine the extracellular matrix degradation by macrophages”的文章,该研究通过深入探究巨噬细胞内部的细胞骨架结构,揭示了中间丝网络在调控巨噬细胞降解ECM过程中的关键作用,为理解巨噬细胞在肿瘤微环境中的复杂功能提供了新的视角。

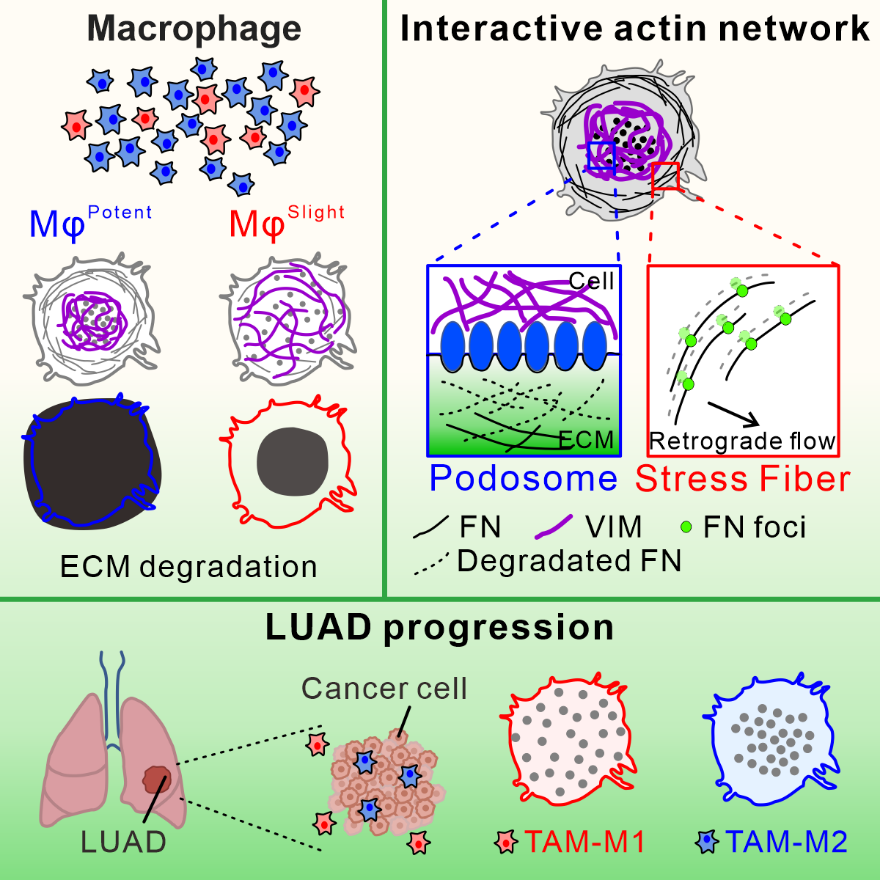
巨噬细胞在肿瘤微环境中的作用备受关注,其降解细胞外基质(ECM)的能力与肿瘤侵袭密切相关。ECM是细胞外的支撑结构,对肿瘤细胞的迁移和侵袭至关重要。巨噬细胞主要通过两种方式降解ECM:一种是ECM组分被细胞内吞并在溶酶体中降解;另一种是释放基质金属蛋白酶(MMPs)等酶类,直接在细胞外分解ECM。在巨噬细胞内部,细胞骨架结构在ECM降解中起着核心作用。但巨噬细胞如何通过细胞骨架结构协调ECM降解的具体机制尚不完全清楚。
研究表明,vimentin作为细胞骨架中间丝蛋白的一种,能与应力纤维相互作用,影响其动态流动。尽管已知应力纤维的动态流动有助于内吞泡的运输,但vimentin在巨噬细胞中如何协调ECM的内部运输仍不明确。此外,vimentin可能通过调控伪足小体的结构和功能影响ECM的降解,但其具体作用尚待进一步研究。
巨噬细胞在肿瘤微环境中具有双重作用。根据激活状态,肿瘤相关巨噬细胞(TAMs)可分为M1型和M2型。M1型巨噬细胞通常具有抗炎和抗肿瘤的特性,而M2型则倾向于促进肿瘤生长和免疫抑制。在肿瘤组织中,M2型巨噬细胞的数量增加与肿瘤的侵袭性和治疗抵抗性密切相关。研究表明,细胞骨架的重塑可能影响巨噬细胞的极化状态,暗示细胞骨架在调控巨噬细胞功能中发挥着关键作用。因此,vimentin通过调控细胞骨架动态,可能间接影响巨噬细胞在肿瘤微环境中的功能。
研究人员发现巨噬细胞内部的vimentin网络在调控ECM降解中起着至关重要的作用。研究人员利用免疫荧光和活细胞成像技术观察到巨噬细胞在降解ECM方面表现出的异质性,并将它们分为降解能力强的MφPotent和降解能力弱的MφSlight两个亚群。进一步分析显示,ActinTight巨噬细胞中的伪足小体区域集中,应力纤维丝长,而ActinLoose巨噬细胞中的伪足小体分布分散,应力纤维短。这些结果表明,巨噬细胞中的应力纤维和伪足小体的组织结构与ECM降解能力密切相关:ActinTight巨噬细胞表现出更强的ECM降解能力,而ActinLoose巨噬细胞则表现出较弱的降解能力。
研究人员利用活细胞成像技术发现应力纤维参与了巨噬细胞胞内ECM蛋白的运输和溶酶体降解。实验表明,破坏应力纤维的形成显著影响了巨噬细胞降解ECM的效率。Vimentin网络对于维持应力纤维和伪足小体之间的平衡至关重要。Vimentin缺失会导致应力纤维长度以及逆向流动速度下降,伪足小体分布分散以及寿命延长,导致MT1-MMP膜定位减少从而降低ECM的降解效率。为了揭示vimentin的作用机制,研究人员进行了RNA测序组学分析,发现相对于野生型细胞,vimentin敲除细胞整合素相关蛋白的基因表达下调,其中CD11b(ITGAM)显著下调。CD11b作为整合素家族的重要成员,在巨噬细胞中发挥着关键作用。通过在vimentin敲除细胞中回补CD11b,研究人员发现可以部分缓解由于vimentin缺失引起的表型,这进一步支持了vimentin通过调控整合素相关蛋白影响ECM降解的机制。
为了验证这些发现在临床中的意义,研究人员分析了肺腺癌患者样本,发现M2型巨噬细胞表现出更紧密的vimentin网络和伪足小体分布。此外,利用不同极化状态THP-1巨噬细胞的结果显示,与M1型巨噬细胞相比,M2型巨噬细胞vimentin网络更加集中,伪足小体分布更加紧密,且ECM降解能力更强。通过Transwell实验和3D共培养系统,研究人员发现M2型巨噬细胞能够显著增强A549肺癌细胞的侵袭能力,而vimentin缺失的 M2型巨噬细胞无法促进肿瘤细胞的侵袭。进一步通过裸鼠皮下成瘤实验,研究人员发现,与只注射肿瘤细胞组以及vimentin缺失巨噬细胞和A549细胞共注射组相比,野生型M2巨噬细胞共注射组的肿瘤组织中胶原纤维显著减少。这些结果揭示了vimentin网络如何协调应力纤维和伪足小体,决定巨噬细胞降解ECM的效率,为理解巨噬细胞在肿瘤微环境中的作用提供了新的视角。
原文链接:https://authors.elsevier.com/a/1kbw5_Yv6zvZT4
中国科学院上海免疫与感染研究所与广州妇女儿童医疗中心联合培养博士后黄心怡为该文章的第一作者;中国科学院上海免疫与感染研究所酒亚明研究员为该文章的通讯作者。该研究得到了国家自然科学基金、中国科学院、上海市科学技术委员会等机构的资助。
【招贤纳士】
中国科学院上海免疫与感染研究所酒亚明研究组一直围绕细胞骨架调控肿瘤转移和病原体感染这两大类疾病开展研究,优化并融合了一系列先进光学成像技术和病毒细菌感染实验体系,从细胞骨架、信号转导和病原体宿主互作等多个角度,深入解析了细胞骨架与疾病的分子机理,旨在为癌症以及相关感染性疾病的精准治疗提供新理论、药物靶点和治疗策略。酒亚明研究员围绕上述工作以通讯作者在Nature Communications, PNAS, Journal of Cell Biology, Advanced Science, Current Biology, eLife等高水平杂志发表文章。课题组研究经费充足(科技部重点研发、国自然基金委等项目支持),现面向海内外英才,诚聘博士后(细胞生物学、微生物学、生物化学、生物信息学、结构生物学、细胞治疗等方向)及技术员(硕士学历)若干,待遇优厚。欢迎志同道合、热爱科研的朋友加入,此招聘长期有效。
研究组详情请见研究所官网:http://siii.cas.cn/sourcedb/zw/rcdw/yjzz/202303/t20230327_6717962.html
附件下载: