肖晖课题组发现cGAMP跨细胞激活STING抗病毒感染新机制
4月10日,国际学术期刊Immunity在线发表了中国科学院上海巴斯德研究所肖晖课题组的研究论文“Transfer of cGAMP into Bystander Cells via LRRC8 Volume-Regulated Anion Channels (VRACs) Augments STING-Mediated Interferon Responses and Anti-viral Immunity”。该研究发现阴离子通道LRRC8/VRAC是一个跨细胞膜转运cGAMP的转运蛋白,能将病毒感染细胞产生的cGAMP转运到非感染细胞中激活STING信号和干扰素应答。这一发现展示出机体抵御病毒感染的独特机制,也为疫苗研发和免疫治疗提供了新思路。

DNA模式识别受体cGAS识别病毒感染细胞或肿瘤细胞中出现在胞浆中的双链DNA后,催化合成二级信使cGAMP。cGAMP通过与内质网ER上的接头分子STING结合激活TBK1/IRF3信号通路,诱导I型干扰素IFN表达,启动宿主防御或肿瘤免疫。虽然传统观念认为cGAMP的作用应该局限于合成它的细胞内,但最近一些证据表明cGAMP也能在细胞间转运,特别是从病毒感染细胞或肿瘤细胞中转移到旁观者细胞中(bystander cells)激活STING并诱导IFN表达。但在病毒感染条件下,细胞转运cGAMP的分子机理和生理意义还不清楚。LRRC8/VRAC是五年前才被发现的调控低渗反应和细胞体积的阴离子通道,由LRRC8A和它的同源亚基LRRC8B-E形成异源性六聚体行使功能。VRAC在低渗透压下被迅速激活,介导Cl-外流来降低细胞内渗透压、防止细胞膨胀。除了运输氯离子,VRAC还能转运一些有机分子,包括天冬氨酸和谷氨酸、神经递质GABA和抗癌药物顺铂,参与调节生长发育或影响糖尿病和中风。
肖晖组研究人员通过体外筛选意外地发现调节低渗反应的阴离子通道LRRC8/VRAC在抗疱疹病毒HSV-1感染中起重要作用。通过膜片钳电生理技术和液相色谱-质谱联用技术,定性和定量地证明了VRAC是一个cGAMP转运蛋白,它能顺着浓度梯度传导cGAMP向细胞外排(efflux)或内流(influx)。除了低渗条件,研究人员发现炎症因子TNF和IL-1也能激活VRAC。因此在病毒感染时,VRAC被炎症因子激活后,能将病毒感染细胞合成的cGAMP转运出来,透过transwell转移到共培养的未感染细胞中,激活STING并诱导IFN表达。在VRAC基因敲除的小鼠中,HSV-1感染诱导的IFN反应降低,病毒载量增高,表明cGAMP在旁观者细胞中诱导的IFN在抵御HSV-1病毒感染中至关重要。该研究不仅揭示了LRRC8/VRAC调控cGAMP转运的作用机制和生理功能,而且为研发抗病毒疫苗、优化肿瘤免疫治疗提供了新思路。
中国科学院大学博士研究生周纯、兰州大学/上海巴斯德研究所联合培养博士生陈霞、德国莱布尼茨分子药理研究所博士后Rosa Planells-Cases为论文的共同第一作者,肖晖研究员和德国莱布尼茨分子药理研究所Thomas J. Jentsch教授、美国约翰斯霍普金斯大学医学院的Zhaozhu Qiu教授为论文的共同通讯作者。该研究得到了国家科技部重点研发计划、国家自然基金委、中国科学院国际合作重点项目和战略性先导专项的资助。
全文链接:https://www.sciencedirect.com/science/article/pii/S1074761320301291?via%3Dihub
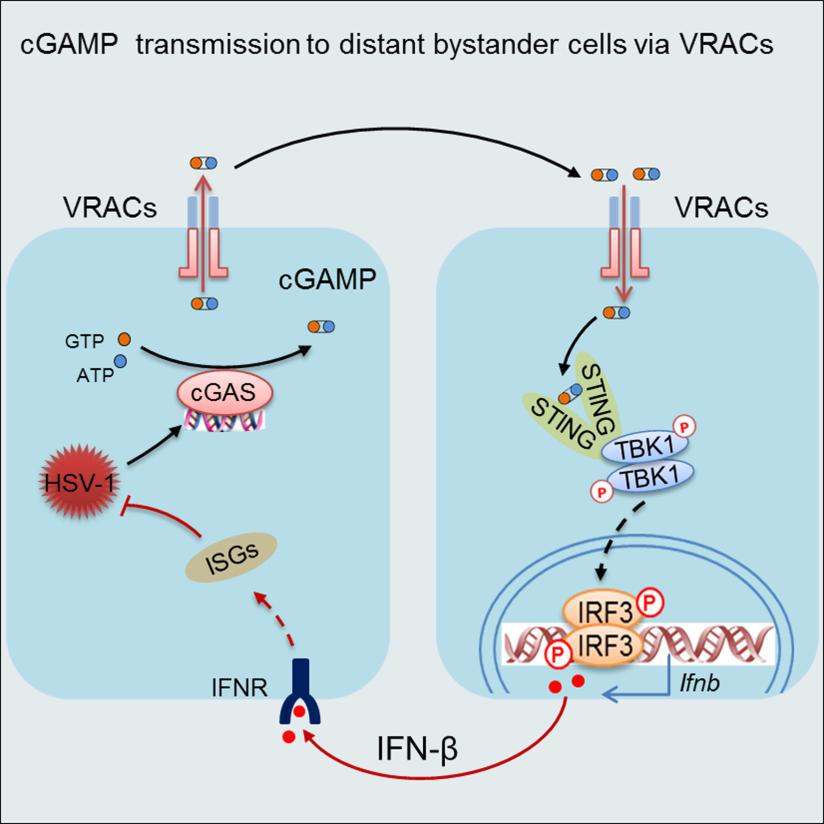
图示:cGAMP通过LRRC8/VRAC从病毒感染细胞转运到未感染细胞中激活STING和IFN的模式图。
附件下载: