肖晖课题组在饮食营养和肠道菌群调节肠炎和癌症方面取得重要进展
3月16日,国际学术期刊Journal of Clinical Investigation在线发表了中国科学院上海巴斯德研究所肠道菌与发育和健康中心肖晖课题组的研究论文“Gut epithelial TSC1/mTOR controls RIPK3-dependent necroptosis in intestinal inflammation and cancer”。该研究发现mTOR信号通路是感知饮食和肠道菌群,调控肠上皮细胞坏死,维持肠道稳态的关键通路,为炎症性肠病和肠癌的药物研发和治疗提供了新思路。
炎症性肠病IBD (Inflammatory Bowel Disease) 包括克罗恩病 (Crohn’s disease) 和溃疡性结肠炎 (Ulcerative colitis),是临床上常见的消化道疾病,其发病原因非常复杂,往往涉及到遗传基因、饮食和肠道菌等环境因素之间的相互作用。由于现代生活方式、饮食结构的变化,IBD的发病率在世界范围内逐年上升。但我们目前对IBD的致病机理还缺乏深入了解,治疗手段也非常有限,因此迫切需要全面挖掘IBD的致病机制。近几年的研究表明磷酸激酶RIPK3和效应分子MLKL介导的程序性坏死在影响肠道上皮细胞的稳态平衡,促进慢性肠炎中起重要作用。但肠道中调控细胞坏死的分子机制还不清楚,特别是与饮食营养和肠道菌群的关系不明确。
mTOR是整合细胞内、外的营养和生长信号,参与调节细胞代谢、生长和分化发育的核心分子,其活性受到TSC1和TSC2异源二聚体的精细调控。研究人员首先发现高脂、高蛋白饮食可以促进肠上皮细胞mTOR信号通路激活和细胞坏死,加剧小鼠肠炎的恶化。此外,mTOR激活和细胞坏死在IBD病人中呈现正相关性,表明mTOR通路可能参与肠炎致病。接下来,研究人员利用Tsc1肠上皮细胞特异性敲除小鼠进一步研究mTOR通路在肠炎中的功能。研究发现Tsc1敲除小鼠在稳态情况下肠上皮细胞坏死增加,肠道屏障功能受损;在DSS诱导小鼠肠炎时,Tsc1敲除小鼠肠上皮细胞坏死加剧,表现出更强的炎症反应和更高的死亡率。进一步敲除坏死调节分子RIPK3或MLKL后,Tsc1敲除小鼠中小鼠肠炎症状得到明显改善,表明调节性细胞坏死在其中起着关键作用。机制上,该研究发现了调节RIPK3降解的一个新E3泛素连接酶TRIM11,其活性受到mTOR信号和肠道菌群的调节。去除肠道菌可以下调RIPK3表达,减轻肠上皮细胞坏死及肠炎的发生。此外,研究人员还利用AOM/DSS诱导的结肠癌模型,证明mTOR-RIPK3在结肠癌发病中也起着重要作用,为结肠癌的治疗提供了新靶点。
中国科学院大学博士谢亚栋为论文的第一作者,硕士赵亦帆为第二作者,肖晖研究员和复旦大学医学院的李华斌教授为论文的共同通讯作者。本研究得到了国家自然科学基金委国际合作重点项目、科技部重点研发计划、中科院先导B等项目的资助。
全文链接:https://www.jci.org/articles/view/133264
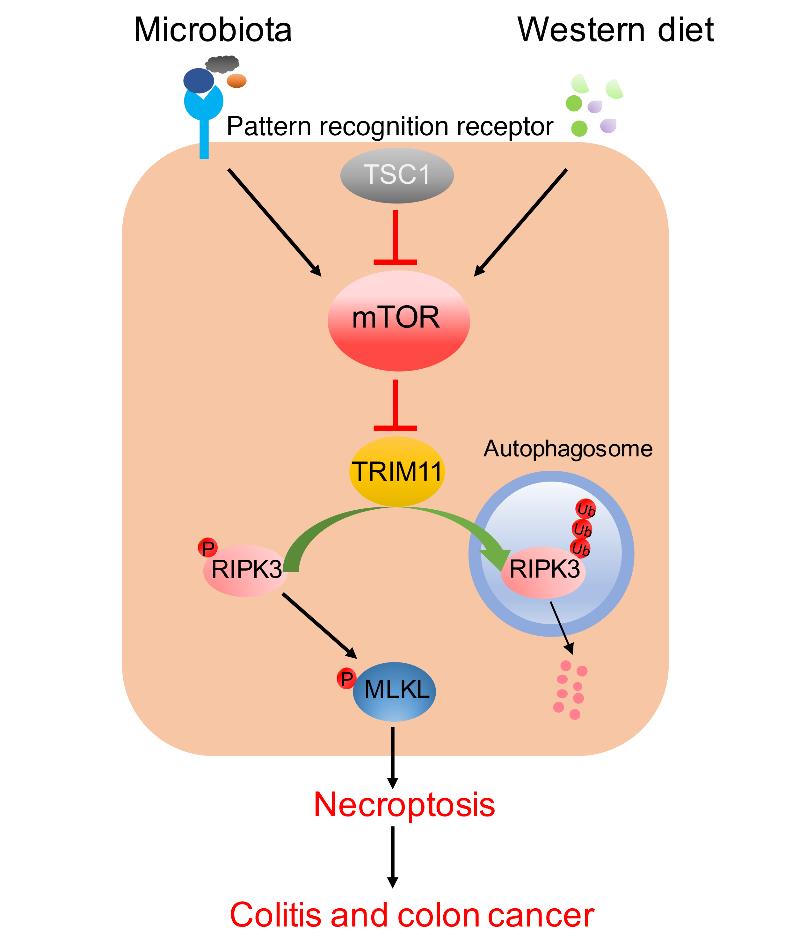
图示:饮食营养和肠道菌群调节肠上皮中TSC1/mTOR和TRIM11/RIPK3信号,影响细胞坏死和肠炎、肠癌的模式图。
附件下载: