肖晖课题组发现DC调节CD8+ T细胞应答新机制
近日,国际学术期刊PLoS Biology在线发表了中国科学院上海巴斯德研究所肖晖课题组的研究论文“TSC1/mTOR-controlled metabolic-epigenetic cross talk underpins DC control of CD8+ T-cell homeostasis”。
树突状细胞(Dendritic cell, DC) 是免疫系统的前哨兵,广泛分布于体表、粘膜和脏器中,主要通过“模式识别受体”识别入侵的病原体,并通过复杂的信号转导通路将病原体信息转化成相应的细胞因子和抗原等信息,传递给初始(na?ve) T细胞以启动恰当的T细胞和B细胞应答,实施高效专一的宿主防御。DC作为最强大的抗原递呈细胞,能高效地摄取、加工和递呈抗原,并迁移到引流淋巴结中指导初始T细胞的分化。虽然DC在介导T细胞应答中至关重要,但目前对DC如何整合组织微环境信号和营养代谢信息,从而启动组织区域特异性的T细胞免疫应答仍然缺乏了解。mTOR是整合细胞内、外的营养和生长信号,参与调节细胞代谢、生长和分化发育的核心分子,其活性受到TSC1和TSC2异源二聚体的精细调控。
肖晖课题组利用DC细胞Tsc1特异性敲除的小鼠(CD11c-cre:Tsc1floxed, Tsc1DC-/-),对DC在调节CD8+ T细胞应答中的作用进行了深入的研究,并阐明了相关的分子机制。研究人员发现,在DC细胞中敲除Tsc1后,DC本身的发育和分化并没有受到影响,但是Tsc1DC-/-小鼠却呈现出有趣的T细胞方面的缺陷,主要表现为CD8+ T细胞的发育和稳态维持受损。机制研究表明,Tsc1的敲除导致mTOR活性增高,因此促进了包括脂肪酸合成在内的一系列细胞代谢过程。DC细胞主要通过递呈抗原、分泌细胞因子等方式与T细胞互作,相应地,全基因组表达谱分析显示TSC1缺陷的DC中MHC-I和IL-7表达下降,由此促进初始CD8+ T细胞的凋亡。海马和代谢组学分析进一步揭示DC细胞中ACC1高表达促进脂肪酸过度合成,从而造成对有限的乙酰辅酶A资源的不合理消耗,导致Il7和H2-K1(编码MHC-I)基因启动子区域的组蛋白乙酰化减少,进而导致其表达量的降低。在胞内致病菌李斯特菌感染和B16黑色素瘤模型中,Tsc1DC-/-小鼠丧失了产生抗原特异杀伤性CD8+ T细胞的能力,因此不能有效地清除细菌感染或抑制肿瘤生长。这一研究揭示了DC-T细胞互作的新机制,突出了细胞代谢与表观遗传偶联机制在调控DC功能中的重要性,为治疗感染性疾病和肿瘤提供了新的靶点。
联合培养博士生石磊、陈霞为论文的共同第一作者,肖晖研究员和兰州大学的杨金波教授、广州医科大学的冷启彬教授为论文的共同通讯作者。本研究得到了中科院先导B计划、国家重点研发计划、国家自然科学基金和中国科学院国际合作重点项目的资助。
全文链接:https://doi.org/10.1371/journal.pbio.3000420
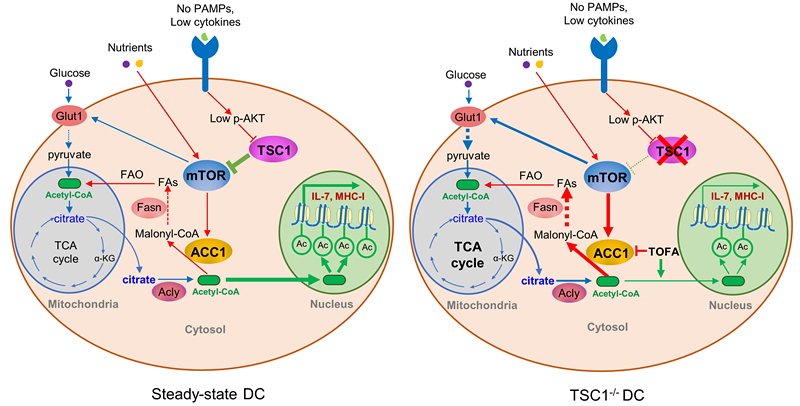
图示:DC中TSC1-mTOR-ACC1调控CD8+ T细胞应答的分子机制示意图。
附件下载: