上海巴斯德所发现DNA解旋酶PfRecQ1调控恶性疟原虫抗原变异基因家族相互排斥性表达的分子机制
2月6日,国际重要学术期刊《美国科学院院报》(Proceedings of the National Academy of Sciences of the United States of America)在线发表了中国科学院上海巴斯德研究所江陆斌课题组题为“DNA helicase RecQ1 regulates mutually exclusive expression of virulence genes in Plasmodium falciparum via heterochromatin alteration”的最新研究成果。
疟疾是一类严重威胁人类健康的寄生虫病。致病性最强的恶性疟原虫每年在全世界范围内造成数以亿计的临床感染病例,并导致近50万人死亡。恶性疟原虫独特的var基因家族(约60个基因组成)编码的变异抗原PfEMP1是恶性疟原虫在病人体内实现免疫逃逸的关键因子。在感染红细胞过程中,单个恶性疟原虫在特定时间内只能表达某一个var基因,恶性疟原虫利用这种相互排斥性表达策略来逃避人体对PfEMP1抗原的免疫反应。阐明var基因家族的表达调控机制有望为疟疾疫苗和抗疟药的研发提供新的靶点,因此,这方面研究一直是领域的国际前沿与热点。
江陆斌团队曾先后证明组蛋白甲基化酶PfSET2(Nature,2013)与一类长链非编码RNA(Front Microbiol,2018)分别参与调节了var基因的沉默和激活。但由于传统的恶性疟原虫基因编辑技术周期长、效率低,直接阻碍了研究人员对整个var基因调控网络的解析,因此其他相关调控因子目前仍不清楚。江陆斌团队利用自主研发的基于CRISPR/dCas9系统的、高效的恶性疟原虫表观遗传基因编辑技术(PNAS,2018),在本研究中证实DNA解旋酶PfRecQ1是维持var基因家族相互排斥性表达的关键因子。研究人员在恶性疟原虫中敲除PfRecQ1后,整个var基因家族处于沉默状态;而在敲除株中回复表达PfRecQ1后,又恢复了var基因相互排斥性表达的表型。进一步的研究表明,PfRecQ1控制了var基因转录起始位点附近组蛋白H3K9me3修饰,并且通过调节var基因在细胞核内周上的定位调控var基因的表达。这一研究成果为我们深入理解恶性疟原虫免疫逃逸的分子机理提供了新的线索,并为新型抗疟药的研发提供了一个全新的潜在靶点。
中国科学院大学硕士研究生李舟,博士研究生尹世刚、孙茂新(上海科技大学)、程秀为本文并列第一作者,江陆斌研究员及其团队的副研究员戴雪瑜和博士研究生黄正辉为本文的共同通讯作者。该研究得到了科技部国家重点研发计划、国家科技重大专项、国家自然科学基金、中科院国际合作项目和美国国立卫生研究院(R01)等项目的资助。
全文链接:https://www.pnas.org/content/early/2019/02/05/1811766116
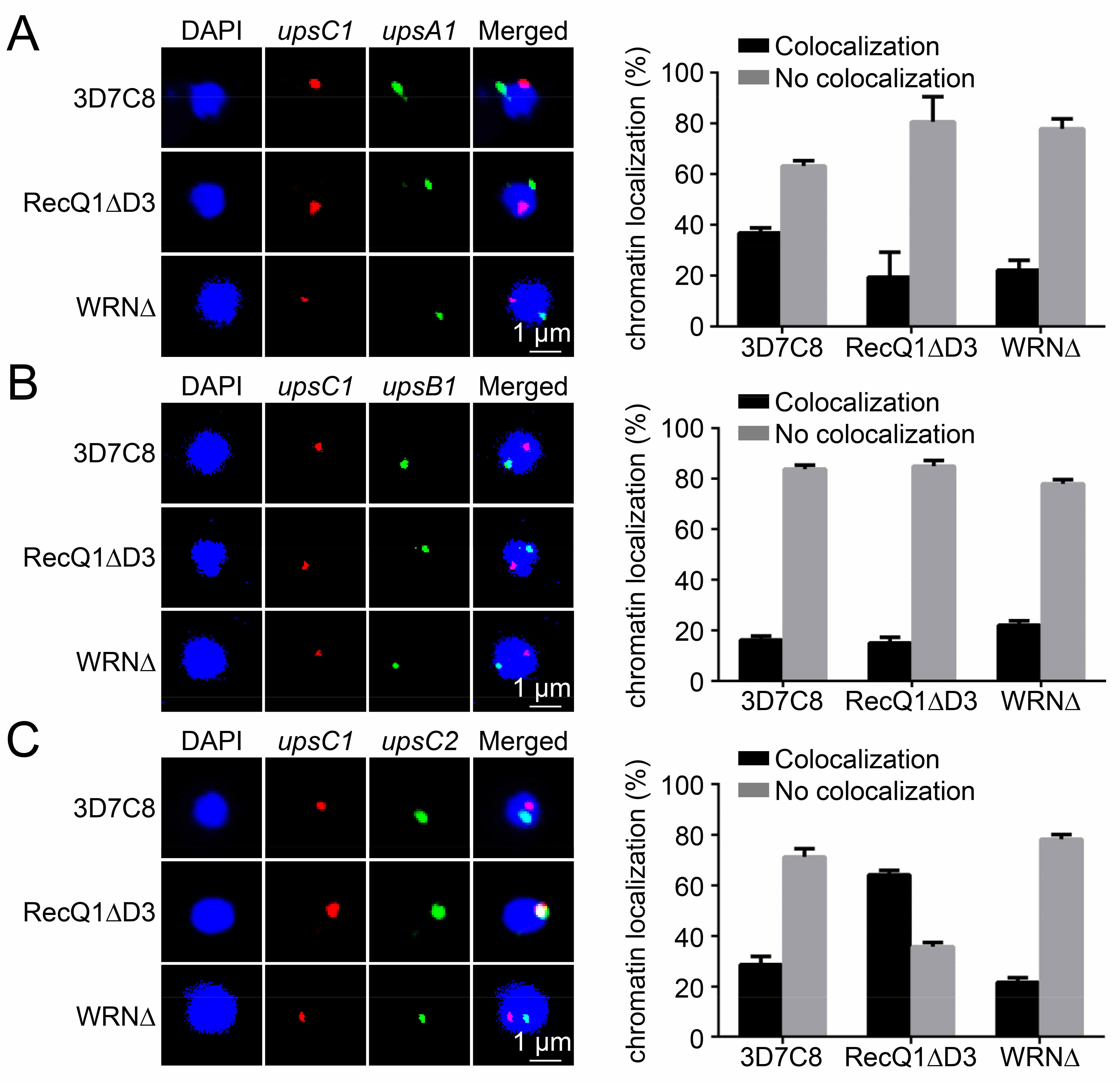
图注:当PfRecQ1缺失后,var基因转录状态发生变化,其所在DNA的核周定位发生重排。
附件下载: