上海巴斯德所发现调控HIV-1复制的重要宿主蛋白
6月11日,国际学术期刊J Biol Chem在线发表了中国科学院上海巴斯德研究所王建华课题组研究论文“Scaffold attachment factor B suppresses HIV-1 infection of CD4+ cells by preventing binding of RNA polymerase II to HIV-1’s long terminal repeat”。该研究揭示了宿主蛋白SAFB1通过抑制磷酸化的RNA聚合酶II结合HIV-1启动子LTR(长末端重复)从而调控HIV-1的转录与潜伏。
潜伏的HIV-1不能被抗逆转录病毒药物清除,这是当前实现HIV/AIDS根治的主要难点。根治策略的发展亟待潜伏机制的深入研究。HIV-1 LTR驱动的前病毒DNA转录水平的抑制是病毒维持潜伏的关键。LTR活性受到宿主因子和病毒本身蛋白的多重调控。
王建华研究组利用基因芯片技术筛选了多种能够调控HIV转录的宿主细胞因子,并对其中具有代表性的宿主因子进行了系列深入研究。陆续报道宿主因子Naf1(HIV Nef-associated factor 1)通过抑制NF-κB信号通路的激活,阻断LTR启动子驱动的病毒转录,维持HIV潜伏(Li C, et al., 2016, J Virol);以及宿主因子Sun2(Sad, UNC-84 domain protein)通过与核纤层蛋白Lamin A/C相互作用,维持抑制性染色质特性,调控HIV的潜伏(Sun WW, et al., 2018, mBio)。
宿主蛋白SAFB1(Scaffold attachment factor B)广泛表达于多种细胞,同时含有RNA结合结构域及DNA结合结构域,通过羧基端结构域结合多种细胞核内蛋白,参与基因表达调控、RNA剪接及DNA损伤修复。博士研究生马力等在王建华研究员的指导下,发现SAFB1能够显著抑制HIV-1感染宿主靶细胞CD4+T细胞,进一步分析揭示SAFB1结合于HIV-1 LTR区域,抑制HIV-1的转录起始及转录延伸。机制上,SAFB1通过羧基端富含精氨酸及甘氨酸的结构域结合磷酸化的RNA聚合酶II,阻止磷酸化的RNA聚合酶II结合于HIV-1 LTR,进而抑制HIV-1的转录进程。在HIV-1潜伏细胞中,敲除SAFB1能够显著增加HIV-1前病毒的激活。该研究发现调控HIV-1复制和潜伏的重要宿主蛋白,为抗病毒策略设计提供了宿主新靶点。
该研究得到苏州大学熊思东教授及中科院上海巴斯德研究所金侠研究员的大力支持。该研究得到来自国家基金委、中科院及科技部艾滋病和病毒性肝炎重大传染病防治专项等项目的资助。
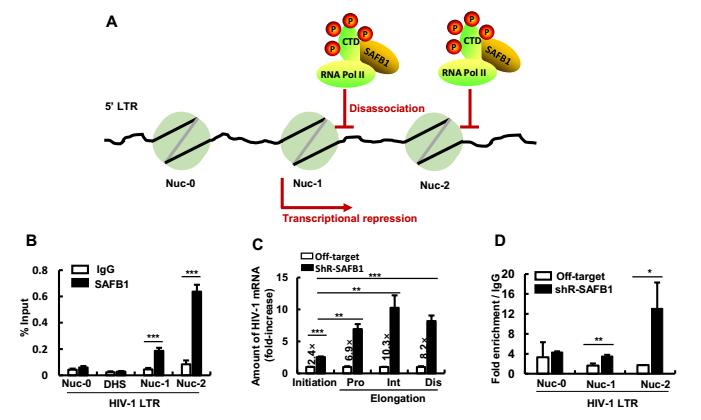
SAFB1干扰RNA聚合酶II活性调控HIV-1转录与潜伏
(A) SAFB1调控HIV-1转录与潜伏机制示意图。SAFB1结合磷酸化的RNA聚合酶II,抑制磷酸化的RNA聚合酶II结合于HIV LTR,从而抑制HIV-1转录,调控HIV-1潜伏。(B) SAFB1结合于HIV-1 LTR Nuc-1与Nuc-2区域。(C) 敲低SAFB1表达增强HIV-1的转录起始与转录延伸。(D) 敲低SAFB1表达促进磷酸化的RNA聚合酶II结合HIV-1 LTR。
文章链接:http://www.jbc.org/content/early/2018/06/08/jbc.RA118.002018.abstract
附件下载: