科研进展
上海巴斯德所揭示表观调控蛋白MLL5参与抗病毒免疫反应的功能及机制
发表日期: 2018-03-29
3月28日,国际学术期刊Nature Communications在线发表了中国科学院上海巴斯德研究所张岩研究组的研究论文“MLL5 suppresses antiviral innate immune response by facilitating STUB1-mediated RIG-I degradation”。该研究揭示了表观遗传调控蛋白Mixed Lineage Leukemia 5 (MLL5)在抗病毒天然免疫过程中的新的调控机制。研究发现MLL5介导病毒RNA受体RIG-I与其E3泛素连接酶STUB1的结合,促进STUB1对RIG-I蛋白K48位泛素化修饰与蛋白降解,进而调控宿主抗病毒天然免疫过程。
RIG-I蛋白是细胞质中主要的病毒RNA受体,可以识别细胞内RNA病毒的感染并激活下游抗病毒的天然免疫反应。RIG-I蛋白的水平受到严格的调控,以维持体内处于合适的免疫稳态,防止过强的免疫反应损伤自身。Trithorax蛋白家族是一类在进化中非常保守的表观遗传调控蛋白,参与细胞核内组蛋白H3K4的甲基化修饰与基因的转录调控。MLL5是Trithorax蛋白家族的重要成员,在造血干细胞“自我更新”、精子发生、细胞周期调控等过程中发挥了重要的作用,但其在抗病毒天然免疫过程的作用之前未有研究。
在本项研究中,博士研究生周培培在其硕士阶段的工作基础上(THE JOURNAL OF BIOLOGICAL CHEMISTRY,2013:288:17532-17543),进一步发现了MLL5在RIG-I介导的抗病毒天然免疫过程中的负性调控作用。RNA病毒Vesicular stomatitis virus (VSV)感染MLL5基因敲除的HEK293T细胞后,细胞产生的I-干扰素与炎症因子的水平明显增加,同时VSV的复制能力显著降低。与此同时,DNA病毒Herpes simplex virus (HSV-1)感染在MLL5基因敲除的细胞,其I-干扰素与炎症因子的产生水平没有变化,显示MLL5特异性地参与了RNA病毒诱导的免疫反应的调控。相应地,与野生型对照小鼠相比,Mll5基因敲除小鼠对VSV病毒的感染更为耐受,能够产生更多的IFN-β、TNFα和IL6细胞因子。进一步的研究发现,MLL5基因缺失后,尽管DDX58基因(编码RIG-I蛋白)的转录没有增加,但RIG-I蛋白显著增加,并且K48泛素化修饰水平降低,显示RIG-I蛋白的降解受到抑制。蛋白定位研究发现,尽管大多数MLL5蛋白分布在细胞核中,一小部分MLL5蛋白定位在细胞质中。免疫共沉淀与蛋白质谱研究发现,胞浆中的MLL5能够介导RIG-I以及E3泛素化酶STUB1结合。STUB1是RIG-I蛋白特异性的E3泛素化酶,可以催化RIG-I蛋白第K48位的泛素化修饰,促进RIG-I蛋白的降解。当MLL5蛋白缺失后, RIG-I与STUB1的结合减弱,RIG-I蛋白的降解受抑制,进而导致RIG-I在细胞中的积累。相应地,当在细胞中过表达MLL5蛋白时,RIG-I与STUB1的结合显著增强,促进RIG-I蛋白的K48位泛素化修饰和溶酶体途径的降解。有趣的是,在VSV感染后,细胞核内的MLL5蛋白会想胞浆中转移,促进对RIG-I蛋白的降解。该研究揭示了表观遗传调控因子MLL5蛋白,通过一种不同于经典的表观遗传调控的作用机制,参与机体抗病毒天然免疫的调节,并且为天然免疫的调控提供给了新的靶点。
该研究是在张岩教授的指导下,由上海巴斯德所的研究生周培培等人完成。该研究获得了上海巴斯德所孟广勋研究员、肖晖研究员、钟劲研究员,中科院生化细胞所侯法建研究员,上海交通大学免疫学研究所李斌教授,国立新加坡大学邓力文教授的大力支持。该项目获得了国家自然科学基金委员会、科技部与中科院的经费支持。
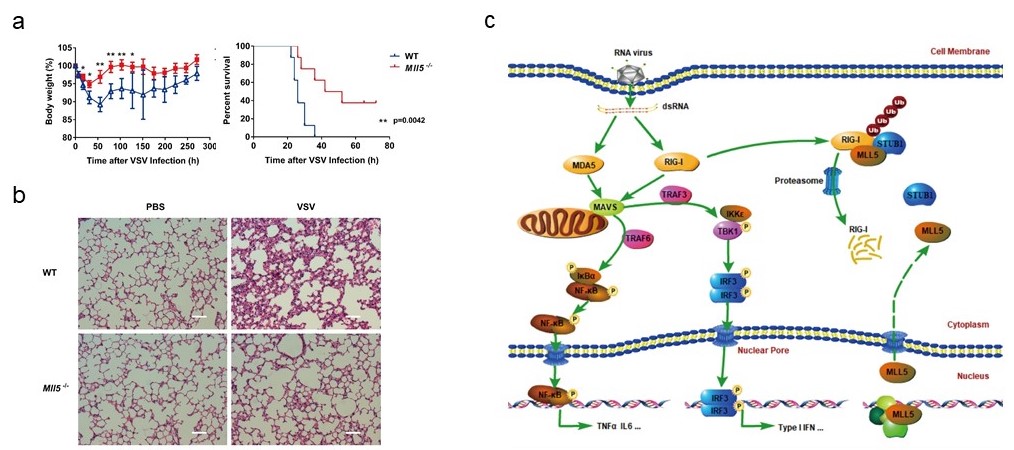
(a)野生型和mll5基因敲除小鼠对VSV-GFP感染后体重变化曲线和存活率曲线。(b)野生型和mll5基因敲除小鼠病毒感染后肺部组织HE染色。(c)MLL5调控RLR通路模式图。
文章链接:https://www.nature.com/articles/s41467-018-03563-8
附件下载: